- Trioxid de sulf Proprietăți chimice, utilizări, producție
- Proprietăți chimice
- Proprietăți fizice
- Utilizări
- Metode de obținere
- Descriere generală
- Aer & Reacții cu apa
- Profilul de reactivitate
- Pericol
- Pericol pentru sănătate
- Pericol de incendiu
- Profil de siguranță
- Expunere potențială
- depozitare
- Expediție
- Incompatibilități
- Eliminarea deșeurilor
Trioxid de sulf Proprietăți chimice, utilizări, producție
Proprietăți chimice
Trioxidul de sulf, S03, cunoscut și sub numele de anhidridă sulfurică, ace sau polimer, există într-o serie de modificări care diferă în ceea ce privește speciile moleculare și forma cristalină. Are o modificare albă, asemănătoare cu gheața, care se topește la 16°C (61°F) și alte două forme asemănătoare cu bestos, care se topesc la temperaturi mai ridicate de 33 și 62°C (90 și 144°F). Forma lichidă sau gazoasă incoloră are vapori iritanți și toxici și fierbe la 45 °C (112 °F).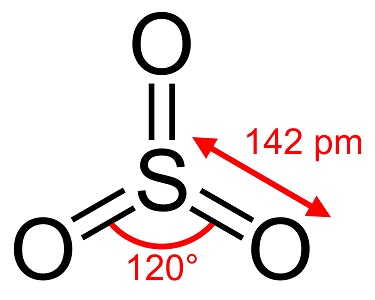
Trioxidul de sulf este o substanță foarte reactivă, un agent oxidant puternic și un pericol de incendiu. Acesta reacționează cu oxizi metalici pentru a forma sulfați și cu apa pentru a forma acid sulfuric. Trioxidul de sulf este utilizat pentru sulfonare.
Proprietăți fizice
Lichid incolor la temperatura ambiantă și la presiunea atmosferică; emană vapori în aer.
Trioxidul de sulf are tendința de a se polimeriza, în special în prezența urmelor de apă sau de acid sulfuric. Cu toate acestea, rata de polimerizare scade foarte mult pe măsură ce se apropie de punctul său de congelare. Trioxidul de sulf solid (polimeric) există în trei faze polimorfe: modificări alfa, beta și gama.
Faza alfa este formată din ace asemănătoare gheții, având o structură polimerică reticulată. Se topește la 62,3°C și are o presiune de vapori de 73 torr la 25°C.
Faza beta este un alotrop metastabil cu ace albe, asemănătoare azbestului, lucioase, alcătuite din molecule polimerice, care se topesc la 32,5°C și cu o presiune de vapori de 344 torr la 25°C.
Modificarea gamma, la temperaturi obișnuite, poate exista sub formă solidă sau lichidă. În formă solidă este o masă coloidală asemănătoare gheții care se topește la 16,8°C. În formă lichidă are o densitate de 1,9224 g/mL, clocotind la 44,8°C. Are o presiune de vapori de 433 torr la 25°C. Faza gamma este formată atât din molecule de trimere ciclice, cât și din molecule de monomer. Când trioxidul de sulf solid se topește, se transformă în faza sa gamma care, la solidificare, se transformă în modificarea alfa.
Temperatura critică a SO3 este de 217,8°C; presiunea critică 80,97 atm; densitatea critică 0,63 g/cm3; constanta dielectrică a SO3 lichid la 18°C este de 3,11.
Trioxidul de sulf se dizolvă în apă formând acid sulfuric și generând căldură mare.
Utilizări
Trioxidul de sulf este utilizat ca intermediar la fabricarea acidului sulfuric și a oleumului pentru sulfonarea, în special a coloranților și a substanțelor colorante, precum și pentru producerea de acid azotic anhidru și de explozivi. Trioxidul de sulf solid este comercializat sub denumirile Sulphan și Triosul și este utilizat în principal pentru sulfonarea acizilor organici. Tetrafluorura de sulf este un agent de fluorinare. Hexafluorura de sulf servește ca izolator gazos în instalațiile electrice de înaltă tensiune. Fluorura de sulfil este utilizată ca insecticid și fumigant.
Sulfonarea compușilor organici, în special a detergenților neionici, a colectoarelor de energie solară. Se generează, de obicei, în instalația în care urmează să fie utilizat.
Metode de obținere
Trioxidul de sulf este produs ca intermediar în fabricarea acidului sulfuric prin procedeul de contact (vezi Acid sulfuric). Procesul implică oxidarea catalitică a dioxidului de sulf în trioxid.
Trioxidul de sulf se prepară în laborator prin încălzirea acidului sulfuric fumant, condensarea vaporilor acestuia și colectarea într-un recipient rece. Când vaporii sunt condensați sub 27°C în prezența unor urme de umiditate, se produc toate cele trei faze polimorfe de SO3. Acestea pot fi separate prin distilare fracționată. Condensarea vaporilor la peste 27°C formează varianta lichidă a trioxidului de sulf gama.
Descriere generală
Trioxidul de sulf, este un solid cristalin incolor până la alb, care emană vapori în aer. Adesea este livrat cu un inhibitor pentru a preveni polimerizarea. Trioxidul de sulf reacționează violent cu apa pentru a forma acid sulfuric cu degajare de căldură. Trioxidul de sulf este coroziv pentru metale și țesuturi. Trioxidul de sulf provoacă arsuri oculare și cutanate. Ingerarea provoacă arsuri grave ale gurii, esofagului și stomacului. Vaporii sunt foarte toxici prin inhalare. Trioxidul de sulf reprezintă un risc de incendiu atunci când intră în contact cu materiale organice, cum ar fi lemnul, bumbacul, fibrele de lemn etc.
Aer & Reacții cu apa
Se combină cu apa cu forță explozivă, formând acid sulfuric datorită acidității sale Trioxidul de sulf carbonizează majoritatea substanțelor organice. La expunerea la aer Trioxidul de sulf absoarbe rapid umiditatea, emițând vapori albi și denși .
Profilul de reactivitate
Reacția dintre trioxidul de sulf și difluorura de oxigen este foarte viguroasă și se produc explozii dacă reacția se desfășoară în absența unui solvent . Reacția trioxidului de sulf în exces cu tetrafluoroetilenă provoacă o descompunere explozivă în fluorură de carbonil și dioxid de sulf . Reacția acidului percloric anhidru cu trioxidul de sulf este violentă și este însoțită de o dezvoltare de căldură considerabilă (Pascal 16:300 1931-34). Trioxidul de sulf lichid reacționează violent cu clorura de nitril, chiar și la 75° C. Reacția dintre trioxidul de sulf și oxidul de plumb produce o luminiscență albă. Combinația de iod, piridină, trioxid de sulf și formamidă a dezvoltat un gaz suprapresurizat după câteva luni. Acest lucru se datorează formării lente a acidului sulfuric, din apa externă sau deshidratării formamidei în cianură de hidrogen.
Pericol
Agent oxidant, risc de incendiu în contact cu materiale organice, la topirea formei α are loc o creștere explozivă a presiunii de vapori. Anhidridulse combină cu apa, formând acid sulfuricși dezvoltând căldură. Foarte toxic, puternic iritant pentru țesuturi.
Pericol pentru sănătate
Trioxidul de sulf este foarte toxic. Este iritant și coroziv pentru membranele mucoase. Otrăvitor dacă este inhalat sau înghițit. Contactul provoacă arsuri grave la nivelul pielii și al ochilor.
Pericol de incendiu
Risc de incendiu în contact cu materiale organice. La topirea formei alfa are loc o creștere explozivă a presiunii vaporilor. Se combină cu apa cu violență explozivă, formând acid sulfuric. Poate aprinde alte materiale combustibile (lemn, hârtie, ulei, etc.). Gazele otrăvitoare inflamabile se pot acumula în rezervoare și vagoane-cisternă. Scurgerea în canalizare poate crea un pericol de incendiu sau de explozie. Formează acid sulfuric la contactul cu apa. Evitați apa și materialele organice. La expunerea la aer, trioxidul de sulf absoarbe umezeala și emite vapori albi densi.
Profil de siguranță
Otravă prin inhalare. Efecte sistemice la om prin inhalare: tuse și alte modificări pulmonare și olfactive. Un iritant coroziv pentru piele, ochi și membranele mucoase. Reacție violentă cu O2F2, PbO, NClO2, HClO4, P, tetrafluoretilenă, acetonitril, acid sulfuric, dimetilsulfoxid, dioxan, apă, difenilmercur, formamidă, iod, piridină, oxizi metalici. Reacționează cu aburul pentru a forma vapori corozivi și toxici de acid sulfuric. Când este încălzit până la descompunere, emite vapori toxici de SO,. A se vedea și ACIDUL SULFURIC.
Expunere potențială
Trioxidul de sulf este utilizat ca agent de sulfatare și sulfonare pentru detergenți, aditivi pentru uleiuri lubrifiante și alți compuși organici; în colectoarele de energie solară. Este, de asemenea, utilizat ca intermediar în fabricarea acidului sulfuric și la fabricarea explozivilor.
depozitare
Presiunea de vapori a trioxidului de sulf crește rapid odată cu creșterea temperaturilor și, atunci când forma α se topește, creșterea presiunii este explozivă; în consecință, recipientele de transport și depozitare trebuie să reziste la presiuni de 10 până la 15 atm. Trioxidul de sulf reacționează viguros și foarte exotermic cu apa pentru a produce acid hidrosulfuric. Atunci când este expus la aer umed, acesta emană vapori și formează o ceață de acid sulfuric care, în cele din urmă, umple tot spațiul disponibil; de asemenea, corodează metalele. Este un agent oxidant puternic și, în fază lichidă, carbonizează materialele organice.
Expediție
UN1829 Trioxid de sulf, stabilizat, Clasa de pericol: 8; Etichete: 8-Materie corozivă, 6.1-Periculozitate otrăvitoare prin inhalare, Zona de pericol de inhalare B.
Incompatibilități
Combustibil și coroziv. Un oxidant puternic. Reacționează violent cu apa, aburul sau umiditatea, eliberând acid hidrosulfuric coroziv. Reacții violente apar la contactul cu baze puternice; acizi puternici, metale chimic active; agenți reducători; metale fin divizate; cianuri, nitrați, picrați, fulminați, clorați, sulfuri, carburi, fosfor, difluorură de dioxigen, oxid de bariu; oxid de plumb; difenilmercur; alcooli, clorură de nitril; acetonitril, dioxan, tetrafluoroetilenă.
Eliminarea deșeurilor
Returnați buteliile de gaz comprimat reîncărcabile la furnizor. Buteliile nereîncărcabile trebuie eliminate în conformitate cu reglementările locale, de stat și federale. Lăsați gazul rămas să se evacueze încet în atmosferă într-o zonă neconfinată sau într-o hotă de evacuare. Buteliile de tip reîncărcabil trebuie returnate furnizorului original cu toate capacele supapelor și dopurile de ieșire fixate și cu capacele de protecție a supapelor la locul lor.