Această structură apare atunci când două (sau mai multe, de exemplu, bucla ψ) segmente ale unui lanț polipeptidic se suprapun și formează un rând de legături de hidrogen între ele. Acest lucru se poate întâmpla într-un aranjament paralel:
 Sau într-un aranjament antiparalel:
Sau într-un aranjament antiparalel: 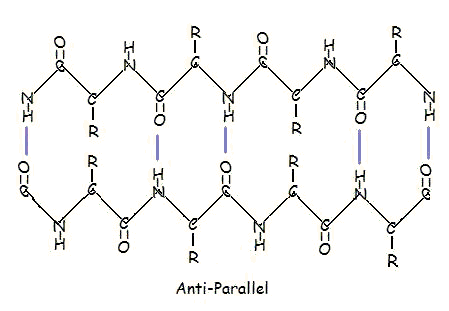
Aranjamentul paralel și antiparalel este consecința directă a direcționalității lanțului polipeptidic. În dispunerea antiparalelă, capătul C-terminal al unui segment se află de aceeași parte cu capătul N-terminal al celuilalt segment. În dispunerea paralelă, extremitatea C-terminală și extremitatea N-terminală se află pe aceleași părți pentru ambele segmente. „Plisarea” apare din cauza planurilor alternante ale legăturilor peptidice dintre aminoacizi; gruparea amino și gruparea carbonil aliniată a fiecărui segment opus își alternează orientarea, de la a fi orientate una spre cealaltă la a fi orientate în direcții opuse.
Dispoziția paralelă este mai puțin stabilă deoarece geometria moleculelor individuale de aminoacizi forțează legăturile de hidrogen să se producă sub un unghi, făcându-le mai lungi și astfel mai slabe. Dimpotrivă, în aranjamentul antiparalel, legăturile de hidrogen sunt aliniate direct opuse una față de cealaltă, ceea ce face ca legăturile să fie mai puternice și mai stabile.
În mod obișnuit, o foaie beta-pleată antiparalelă se formează atunci când un lanț polipeptidic își inversează brusc direcția. Acest lucru se poate întâmpla în prezența a două reziduuri de prolină consecutive, care creează o încovoiere înclinată în lanțul polipeptidic și îl îndoaie înapoi pe el însuși. Acest lucru nu este necesar pentru ca segmentele îndepărtate ale unui lanț polipeptidic să formeze foițe beta-plecate, dar pentru segmentele proximale este o cerință certă. Pentru distanțe scurte, cele două segmente ale unei foițe beta-plecate sunt separate de 4+2n reziduuri de aminoacizi, 4 fiind numărul minim de reziduuri.
.