Proprietăți generale ale sărurilor
Câteva dintre proprietățile caracteristice ale sărurilor sunt:
- Punctele de topire și de fierbere: Sărurile sunt în mare parte solide care se topesc, dar și fierb la temperaturi ridicate.
- Solubilitate în apă: Sărurile sunt în general solubile în apă. De exemplu, clorura de sodiu, sulfatul de potasiu, nitratul de aluminiu, carbonatul de amoniu etc., sunt săruri solubile, în timp ce clorura de argint, clorura de plumb, carbonatul de cupru etc., sunt insolubile în apă.
- Apa de cristalizare: În general, sărurile se găsesc sub formă de cristale cu molecule de apă prezente în ele. Această apă se numește apă de cristalizare și astfel de săruri se numesc săruri hidratate.
De exemplu, cristalul de sulfat de cupru are cinci molecule de apă pentru fiecare moleculă de sulfat de cupru. Acesta se scrie CuSO4.5H2O. Această apă de cristalizare dă cristalului forma sa. De asemenea, ea dă culoare unor cristale. La încălzire, sărurile hidratate își pierd apa de cristalizare și, ca urmare, cristalele își pierd forma și culoarea și se transformă într-o substanță pulverulentă.
Sărurile hidratate care și-au pierdut apa de cristalizare se numesc săruri anhidre.
Când sulfatul de cupru hidratat este încălzit, el cedează moleculele de apă pentru a forma o pulbere albă de sulfat de cupru anhidru. La adăugarea de apă, această substanță se poate transforma din nou în soluție de sulfat de cupru hidratat.
Oamenii mai întreabă
- Clasificarea sărurilor
- Utilități ale diferitelor săruri în viața de zi cu zi
- Prepararea sărurilor
- Descrieți modul de preparare a sărurilor solubile și insolubile
- Calificative Analiza sărurilor
- Acțiunea căldurii asupra sărurilor
- Testarea cationilor și anionilor în soluții apoase
- Construirea ecuațiilor ionice prin metoda variației continue
- Ce este stoichiometria și de ce este folosită în chimie?
Proprietăți generale ale sărurilor :
1. Reacția cu un acid : Când o sare reacționează cu un acid, se formează o altă sare și un alt acid. De exemplu, atunci când clorura de sodiu este încălzită cu acid sulfuric, se produce hidrogenosulfat de sodiu (la temperatură joasă) și apoi sulfat de sodiu (la temperatură ridicată) și se degajă gaz clorură de hidrogen.
2. Reacția cu o bază : O sare reacționează cu o bază pentru a produce o altă sare și o altă bază.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reacția cu un metal : Uneori, o soluție de sare poate reacționa cu un metal. De exemplu, atunci când un cui de fier este scufundat într-o soluție apoasă de sulfat de cupru, cuprul se depune pe suprafața cuiului, iar sulfatul feros format rămâne în soluție.
CuSO4 + Fe → FeSO4 + Cu
Această reacție arată că fierul este mai reactiv decât cuprul.
Din acest motiv, un metal mai reactiv poate deplasa un metal mai puțin reactiv dintr-o soluție a sării sale.
4. Comportarea sărurilor față de apă :
Când o sare este dizolvată în apă, soluția poate fi neutră, acidă sau alcalină. Acest lucru depinde de natura sării folosite.
(i) O sare normală derivată dintr-un acid puternic și o bază puternică dă o soluție neutră. De exemplu, soluțiile apoase de NaCl și K2SO4 sunt neutre la litmus.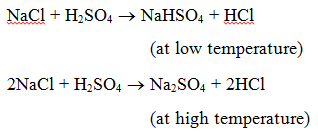
(ii) O sare normală derivată dintr-un acid slab și o bază puternică dă o soluție alcalină. De exemplu, soluțiile apoase atât ale carbonatului de sodiu (Na2CO3), cât și ale acetatului de sodiu (CH3COONa) sunt alcaline.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) O sare derivată dintr-un acid puternic și o bază slabă dă o soluție acidă. De exemplu, atât clorura de aluminiu (AlCl3), cât și clorura de amoniu (NH4Cl) dau soluții apoase acide.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Soluțiile de săruri acide sunt acide la turnesol, adică aceste soluții înroșesc hârtia de turnesol albastră. De exemplu, o soluție de hidrogenosulfat de sodiu (NaHSO4) transformă hârtia de turnesol în hârtie de turnesol albastră roșie.
Soluția de hidrogenocarbonat de sodiu (NaHCO3), însă, este ușor alcalină.
.