S-ați întrebat vreodată de ce bastoanele luminoase (vezi Fig. 1) strălucesc după ce le îndoiți? Sau de ce acele steluțe din plastic încă strălucesc noaptea, după ce luminile au fost stinse? Poate că nu v-ați întrebat. Cu toate acestea, indiferent dacă v-ați pus sau nu aceste întrebări, textul care urmează sperăm că vă va oferi răspunsuri și explicații privind fenomenele brățărilor luminoase, meduzelor strălucitoare, luminii negre și multe altele.

Figura 1. Bastoane luminoase.
Luminescența
În general, strălucirea care apare în toate fenomenele menționate mai sus se numește luminescență. Luminescența este energia eliberată de o substanță sub formă de lumină . Pot fi diferențiate mai multe tipuri de luminescență:
- Un exemplu este chemiluminescența. În timpul unor reacții chimice, energia este eliberată sub formă de lumină. Acest lucru se întâmplă după îndoirea unui băț incandescent. Acesta este, de asemenea, motivul pentru care strălucesc animale precum meduzele sau unele microorganisme. În acest caz, se numește bioluminescență .
- Un alt tip este triboluminescența. Aceasta poate fi observată atunci când un plic autocolant este deschis în întuneric total sau când banda adezivă este derulată într-o cameră întunecată. Procedând astfel, energia mecanică este introdusă în sistem și servește drept activator pentru strălucire .
- Probabil cel mai familiar tip de luminescență este fotoluminescența. Aici, energia este furnizată de radiații electromagnetice, de exemplu prin lumina soarelui sau printr-o lampă cu ultraviolete, ca în unele discoteci. Acest lucru provoacă fenomene precum strălucirea continuă a stelelor de plastic sau strălucirea extremă a hainelor albe sub lumină neagră. Se pot diferenția fluorescența și fosforescența, care vor fi explicate mai jos .
Ce este o stare excitată electronic?
În general, toate tipurile de luminescență se bazează pe așa-numitele procese foto-fizice. De obicei, moleculele însele sunt descrise ca fiind fluorescente. Acesta este cazul coloranților fluorescenți precum fluoresceina sau curcumina . Cu toate acestea, pentru a explica procesele foto-fizice, trebuie să privim mai atent la un nivel chiar mai mic decât cel molecular.
Atomii diferitelor elemente au un număr diferit de electroni distribuiți în mai multe învelișuri și orbitali. Electronii sunt un tip de particule elementare. Tranzițiile electronice sunt responsabile de luminescență . Atunci când sistemul absoarbe energie, electronii sunt excitați și sunt ridicați într-o stare energetică superioară. Înainte de excitare, în starea fundamentală, o parte dintre electroni se află în așa-numitul HOMO (Highest Occupied Molecular Orbital). După ce ajung într-o stare excitată, aceștia se află în LUMO (cel mai puțin ocupat orbital molecular neocupat) (a se vedea Fig. 2). Cum funcționează exact acest lucru va fi explicat folosind fotoluminescența ca exemplu specific.

Figura 2. Excitația electronică.
Diferitele stări energetice ale unui atom sau ale unei molecule sunt cunoscute sub numele de „nivele energetice”. În funcție de moleculă și atom, electronii pot ocupa numai niveluri energetice discrete, deoarece energia este cuantificată, ceea ce înseamnă că energia poate fi absorbită și emisă numai în anumite cantități . Diferența dintre două niveluri poate fi calculată cu ecuația 1 (unde E2 este nivelul energetic superior, iar E1 cel inferior).
(1) ΔE = E2-E1
Fotonii, particule din care constă radiația electromagnetică sau lumina, trebuie să aibă o anumită valoare energetică pentru a putea excita electronii. Energia unui foton poate fi calculată cu ecuația 2, unde h este constanta Planck și ν este frecvența luminii.
(2) Efectul = hν
Energia de excitație necesară pentru electroni este egală cu diferența dintre nivelurile energetice. Numai lumina cu o anumită energie și, în consecință, cu o anumită frecvență și lungime de undă, este capabilă să excite electronii . Prin egalizarea ecuațiilor 1 și 2 și cu ajutorul ecuației 3 (unde c reprezintă viteza luminii), se pot calcula frecvența și lungimea de undă necesare (a se vedea ecuația 4) . În multe cazuri, pentru excitare se utilizează radiația UV.
(3) λ = c/ν
(4) ΔE = Efotonul ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Dezactivarea stărilor excitate electronic
Aceste stări excitate electronic sunt instabile. Electronii cad înapoi în stările lor fundamentale. În același timp, energia de excitație este eliberată din nou. Se face distincția între procesele de dezintegrare radiativă și non-radiativă. De cele mai multe ori, dezintegrarea este non-radiativă, de exemplu prin relaxare vibrațională, stingere cu moleculele din jur sau conversie internă (CI) . Aceste procese vor fi explicate în detaliu mai târziu.
Câteodată, o dezintegrare radiativă poate avea loc sub formă de fluorescență și fosforescență. Energia este emisă sub formă de radiație electromagnetică sau fotoni. Lumina emisă are o lungime de undă mai mare și o energie mai mică decât lumina absorbită, deoarece o parte din energie a fost deja eliberată într-un proces de dezintegrare neradiativă . Acesta este motivul pentru care o emisie în spectrul vizibil poate fi obținută prin excitare cu radiații UV nevizibile. Această deplasare spre o lungime de undă mai mare se numește deplasare Stokes .
Comparație: Fluorescența vs. fosforescența
Atât fluorescența cât și fosforescența sunt emisii spontane de radiații electromagnetice. Diferența constă în faptul că strălucirea fluorescenței se oprește imediat după ce sursa de radiație excitantă este oprită, în timp ce pentru fosforescență poate apărea o strălucire ulterioară cu durate de la fracțiuni de secundă până la ore .
Pentru a compara procesele fotofizice care stau la baza celor două fenomene, există câteva date despre electroni care sunt utile pentru înțelegere: Electronii sunt particule care au un așa-numit spin și un număr cuantic de spin. Acesta poate avea două valori diferite, și anume fie +1/2, fie -1/2 . Acest număr este o proprietate pe care, de fapt, nu ne-o putem imagina sau descrie cu ușurință. Este deseori comparat cu un carusel, care se învârte fie în sensul acelor de ceasornic, fie în sens invers. Cu toate acestea, această descriere nu este nici din punct de vedere matematic, nici fizic destul de corectă. Doi electroni dintr-un singur orbital al unui atom au spin antiparalel, care se notează cu (↓) .
Fluorescență
În diagrama Jablonski pentru fluorescență (vezi Fig. 3), starea de spin singlet S0 este starea fundamentală a electronilor, iar S1 și S2 sunt stări excitate singlet (stările sunt folosite doar ca exemplu în acest text și nu se aplică neapărat la anumiți atomi, molecule, etc.). În cadrul acestor stări, există mai multe niveluri energetice. Cu cât nivelul este mai înalt, cu atât mai multă energie posedă un electron atunci când se află în acel nivel. În cazul stărilor singlete, electronii au spini antiparalele.

Figura 3. Diagrama Jablonski pentru fluorescență.
Electronii sunt ridicați din starea fundamentală S0, de exemplu, la un nivel energetic al celei de-a doua stări excitate S2, atunci când sunt excitați de radiația electromagnetică. După ce excitarea se oprește, electronii rămân în acea stare excitată doar pentru o perioadă scurtă de timp (cca. 10-15 s) și apoi încep imediat să coboare înapoi în starea fundamentală . Procedând astfel, energia poate fi inițial eliberată în mediul înconjurător prin relaxare vibrațională. Aceasta înseamnă că energia termică este eliberată prin mișcarea atomului sau moleculei până când este atins cel mai scăzut nivel al celei de-a doua stări excitate.
Distanța mai mare dintre a doua și prima stare excitată este depășită prin conversie internă. Aceasta descrie o tranziție electronică între două stări în timp ce spinul electronilor este menținut. Acum, electronii se pot relaxa și mai mult datorită unei relaxări vibraționale mai mari până când ajung la cel mai mic nivel energetic al stării S1.
Teoretic, electronii s-ar putea relaxa și mai mult într-un mod non-radiativ până când, în cele din urmă, ajung din nou la starea fundamentală. Cu toate acestea, se poate întâmpla ca ultima cantitate de energie să fie prea mare pentru a fi eliberată în mediul înconjurător, deoarece moleculele din jur nu pot absorbi atâta energie. În acest caz, apare fluorescența, care duce la o emisie de fotoni cu o anumită lungime de undă. Emisia durează doar până când electronii se află din nou în starea fundamentală. Deoarece în timpul tuturor acestor tranziții spinul electronului este păstrat la fel, ele sunt descrise ca fiind cu spin permis .
Fosforescența
Pentru fosforescență, lucrurile stau puțin diferit (vezi Fig. 4). Există din nou o stare fundamentală S0 și cele două stări excitate, S1 și S2. În plus, există o stare excitată triplet T1 care se află, din punct de vedere energetic, între stările S0 și S1. Electronii au din nou spini antiparalele în starea fundamentală.
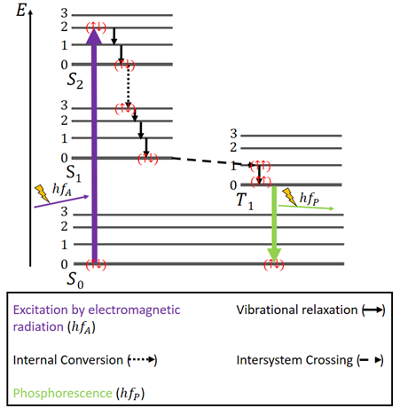
Figura 4. Diagrama Jablonski pentru fosforescență.
Excitația are loc în același mod ca în cazul fluorescenței, și anume prin radiație electromagnetică. Eliberarea de energie prin relaxare vibrațională și conversie internă cu menținerea aceluiași spin este aceeași și în acest caz, dar numai până la atingerea stării S1.
Alături de stările singlet, există și o stare triplet și poate avea loc așa-numita trecere intersistemică (ISC), deoarece starea T1 este mai favorabilă din punct de vedere energetic decât starea S1. Această traversare, ca și conversia internă, este o tranziție electronică între două stări excitate. Dar, spre deosebire de conversia internă, ISC este asociată cu o inversare de spin de la singlet la triplet. Electronii din starea de triplet au spini paraleli, ceea ce se notează cu () . Acest proces ISC este descris ca fiind „cu spin interzis”. Nu este complet imposibil – datorită unui fenomen numit „cuplaj spin-orbită” – totuși, este mai degrabă improbabil .
În starea T1, este posibilă și dezintegrarea non-radiativă. Cu toate acestea, o tranziție între cel mai scăzut nivel energetic al stării triplet și starea S0 nu este ușor posibilă, deoarece și această tranziție este interzisă de spin. Cu toate acestea, se poate întâmpla oricum cu o mică posibilitate. Aceasta determină o emisie destul de slabă de fotoni, deoarece spinul electronului trebuie să fie inversat din nou. Energia este reținută în această stare pentru o perioadă de timp și nu poate fi eliberată decât încet . După ce toată energia a fost eliberată, electronii se află din nou în starea fundamentală .
Concluzie
Procesele cu spin permis și interzis servesc ca explicații pentru o strălucire a fluorescenței care încetează imediat și pentru strălucirea ulterioară a fosforescenței. Fosforescența apare de obicei numai în cazul moleculelor „mai grele”, deoarece spinul trebuie inversat cu ajutorul cuplării spin-orbită. Emiterea de radiații electromagnetice și cu ce lungime de undă depinde de cantitatea de energie care poate fi eliberată în prealabil prin dezintegrare non-radiativă . Depinde, de asemenea, de proprietățile așa-numiților stingători care sunt moleculele înconjurătoare și care sunt capabile să absoarbă cantități mai mari de energie.
Toate procesele care pot duce la o inhibiție a dezintegrărilor radiative pot provoca stingerea fluorescenței. Exemple sunt procesele de dezintegrare non-radiativă, dar și distrugerea moleculei fluorescente . Eficiența cuantică descrie eficiența procesului și este definită ca raportul dintre fotonii absorbiți și cei emiși . Această proprietate este diferită pentru fiecare substanță.
Chiar dacă acest text se concentrează pe fotoluminescență, procesele foto-fizice sunt aceleași pentru toate tipurile de luminescență .
Aplicații
În afară de produse precum bețișoarele luminescente, fluorescența și fosforescența sunt folosite în multe alte moduri. Alte exemple sunt stâlpii de ghidare care conduc la o ieșire de urgență care nu au nevoie de alimentare electrică, dar care strălucesc pe timp de noapte datorită fosforescenței. Chiar și plantele pot fi făcute fluorescente: Spanacul poate fi modificat cu ajutorul nanotehnologiei astfel încât să poată detecta urme de substanțe explozive în apele subterane. Frunzele conțin nanotuburi de carbon de care se pot lega nitroaromatice. Dacă acestea o fac, un semnal fluorescent este eliberat de plantă și poate fi detectat cu ajutorul camerelor cu infraroșu .
VIDEO demonstrează diferite tipuri de luminescență. În partea stângă, acesta arată fluorescența colorantului curcumină, care este conținut în condimentul turmeric, sub lumină UV . Curcumina este dizolvată în alcool pentru a face fluorescența vizibilă.
Păianjenul de plastic și compusul din tubul mic sunt exemple pentru fosforescență. Aluminatul de stronțiu, care este conținut în tub, este excitat inițial de radiația UV și în cele din urmă emite lumină verde. Cauza este o dopare cu elemente precum europiul, care face ca acest compus să poată fi utilizat ca pigment luminescent .
Îndoirea bățului incandescent (în partea dreaptă) inițiază o reacție chimică între peroxidul de hidrogen și un colorant și oxalatul de fenil. Se poate observa chemiluminescența.
Video 1. Fluorescența, fosforescența și chemiluminescența în comparație.
K. Arnold et al., Chemie Oberstufe (în germană), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-01111179-4
Lexikon der Physik: Lumineszenz (în limba germană), spektrum.de. (accesat la 25 ianuarie 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (în germană), chemieunterricht.de 2010. (accesat la 25 ianuarie 2017)
Lexikon der Physik: Photophysikalische Prozesse (în limba germană), spektrum.de. (accesat la 27 ianuarie 2017)
D. Wiechoczek, Chemie mit Curry (în germană), chemieunterricht.de 2015. (accesat la 27 ianuarie 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (în germană), Wiley-VCH, Weinheim, 2008, 853 și urm., 921 și urm. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (în germană), chemie.de. (accesat la 27 ianuarie 2017)
Bohr frequency relation (în germană), chemgapedia.de. (accesat la 25 ianuarie 2017)
Ilmenau University of Technology, Practical Course Physical Chemistry II: Physical Chemistry/Microreaction Technology, Fluorescence Quenching Experiment (în limba germană), tu-ilmenau.de. (accesat la 27 ianuarie 2017)
Stokes shift (în germană), chemie.de. (accesat la 25 ianuarie 2017)
Electron spin (în germană), chemie.de. (accesat la 27 ianuarie 2017)
Quantum yield (în germană), chemie.de. (accesat la 27 ianuarie 2017)
Spanacul detectează explozibili în apele subterane (în germană), Spiegel Online, 1 noiembrie 2016. (accesat la 27 ianuarie 2017)
D. Weiß, Phosphorescence (în germană), chemie.uni-jena.de. (accesat la 27 ianuarie 2017)
 Kim Dreier este elevă la Marianne-Weber-Gymnasium (liceu) din Lemgo, Germania.
Kim Dreier este elevă la Marianne-Weber-Gymnasium (liceu) din Lemgo, Germania.
.