Aspartat aminotransferazade Luke Spooner
Contenit
- 1 Funcție
- 2 Structură
- 3 Funcția
- 4 Aplicații clinice
- 5 Structuri 3D ale aspartat aminotransferazei
Funcția
Aspartat aminotransferaza (AAT), cunoscută și sub numele de glutamic aspartic transaminază, glutamic oxaloacetic transaminază, prefenat aminotransferază și transaminază A este o enzimă care face parte din familia aminotransferazelor dependente de piridoxal-fosfat de clasa I . Este codificată de gena GOT1. Este un homodimer care are o lungime de 413 aminoacizi și are un rol esențial în metabolismul aminoacizilor și al carbohidraților, în ureogeneză și în transferul de echivalenți reducători în mitocondrii și cloroplaste. În celulele procariote se găsește exclusiv în citosol, dar în celulele eucariote există izozime în citosol, mitocondriale și cloroplaste. Aspartatul aminotransferaza bifuncțională (BAAT) este necesară pentru transaminarea prefanatului în arogenat.
În corpul uman este produsă în creier, mușchii scheletici, ficat, pancreas, globule roșii și rinichi . Gama largă de țesuturi în care este produsă, o separă de enzima similară alanină transaminaza (ALT) care se găsește în principal în ficat. Nivelul de AAT din organism poate fi folosit ca marker pentru boli sau leziuni tisulare. De asemenea, nivelurile de AAT și ALT pot fi comparate pentru a preciza dacă leziunile tisulare se găsesc în principal în ficat.
Structură
care conține (elice alfa, fire beta, bucle, răsuciri). Unitatea asimetrică a Aspartat aminotransferazei, cu domeniul mic și mare evidențiat și cofactorul PLP (1b4x). Fiecare subunitate conține un situs activ echivalent. Subunitățile se conectează în două locuri: între domeniile lor mari și între reziduurile N-terminale și domeniul mare al celeilalte subunități. Această structură a AST variază foarte puțin de la un organism la altul, de la E. coli la om. De asemenea, structura situsului activ este foarte bine conservată, cu o omologie a secvenței de 25%.
Care subunitate a homodimerului este împărțită în continuare într-un domeniu mic și unul mare. Acesta este alcătuit din aminoacizii de la N-terminal până la reziduul Pro 48 și de la Met 326 până la C-terminal. Restul de aminoacizi alcătuiesc domeniul , iar the sunt conectați de un α-helix lung format din 32 de aminoacizi.
Domeniul mare este cel în care se găsește situsul activ al AAT și, pentru a acomoda acest lucru, nucleul conține multe structuri supersecundare α/β. Acest lucru este în contrast cu nucleul subunității mici care este format din două α-helice și două β-stranduri. La organismele pluricelulare există o încovoiere la reziduul 325 care acționează ca o balama pentru domeniul mic, ceea ce permite modificările conformaționale rezultate care au loc la legarea inhibitorilor la enzimă.
După cum s-a afirmat mai sus, situsul activ al AST este situat pe domeniul mare al subunității. În cadrul situsului activ se află reziduul amino Lys 258, cunoscut și sub numele de aldimina internă, care se leagă cu cofactorul piridoxal 5′-fosfat () formând ceea ce se numește o bază Schiff. La adăugarea unui substrat de aminoacid, se formează o nouă bază Schiiff între PLP și aminoacid.
Funcție
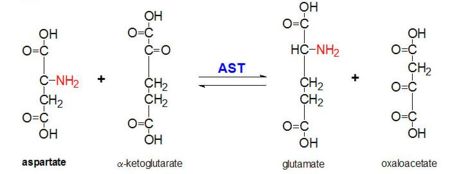
Figura 2: Reacția de transaminare a L-aspartatului și α-cetoglutaratului catalizată de aspartat aminotransferaza
AAT catalizează transaminarea reversibilă a grupării α-amino de la L-aspartat la α-cetoglutarat formând oxaloacetat și glutamat. Această reactivitate este mai mică la E.coli decât la eucariotele superioare și are o specificitate mai largă a substratului. Cu toate acestea, reacția are loc în același mod. La introducerea unui substrat de aminoacid, se va forma o nouă bază Schiff între acesta și cofactorul PLP. Acest lucru face ca aminoacidul să piardă un hidrogen și să formeze un intermediar quinoid, iar reprotanarea are loc, rezultând o cetimină. Apoi, structura este hidrolizată, formând un α-cetoacid și fosfat de piridoxamină. 2-metil aspartatul acționează ca inhibitor al AAT atunci când formează o bază Schiif cu cofactorul PLP, mai degrabă decât cu aspartatul. Acest lucru are ca rezultat oprirea procesului la etapa anterioară eliminării proteinei alfa.
Această reacție este esențială pentru menținerea homeostaziei în organisme. Cele patru molecule diferite care se pot forma ca urmare a acestei transanimări (oxaloacetat, α-cetoglutarat, aspartat, L-glutamat) noastre critice pentru o serie de procese metabolice. Oxaloacetatul și α-cetoglutaratul joacă un rol critic în ciclul Krebs, diferite forme de aspartat sunt molecule importante în ciclul ureei și participă la gluconeogeneză, iar glutamatul este o moleculă importantă în căile metabolice asociate cu memoria.
Aplicații clinice
Nivelurile de AAT din organism sunt un indicator al leziunilor tisulare și al bolilor. În mod normal, AAT se găsește în cantități minime în sânge, însă atunci când organele menționate mai sus sunt deteriorate, AAT este eliberată în sânge. Cantitatea eliberată este proporțională cu nivelul leziunilor suferite. S-a demonstrat că nivelurile de AAT cresc substanțial în termen de 6 ore de la degradarea inițială a țesuturilor și pot rămâne ridicate până la 4 zile. Nivelurile de AAT, atunci când sunt comparate cu nivelurile altor enzime, pot fi folosite de medici pentru a determina în ce parte a corpului a avut loc afectarea. Comparațiile cu ALT s-au dovedit deosebit de utile în identificarea leziunilor hepatice, cum ar fi ciroza și hepatita. În condiții normale, nivelurile de AAT în cadrul bărbaților sunt de 6-34 UI/L, iar în cazul femeilor este de 8-40 UI/L.
Structuri 3D ale aspartat aminotransferazei
Structuri 3D ale aspartat aminotransferazei
.