Secțiunea anterioară arată cum diferite elemente pot exista singure sau se pot combina cu alte elemente pentru a forma compuși. Această secțiune se bazează pe aceste idei, analizând reacțiile chimice mai în detaliu. Ea arată, de asemenea, cum poate fi extinsă prescurtarea chimică pentru a descrie reacțiile chimice.
În primul rând, luați în considerare unele dintre moleculele descrise mai devreme: apă, metan, dioxid de carbon și amoniac.
Întrebare 26
Care sunt formulele pentru fiecare dintre aceste patru molecule?
Răspuns
Formulele sunt H2O, CH4, CO2 și, respectiv, NH3.
Deși nu este necesar să rețineți formulele chimice ale compușilor introduși în acest curs, probabil că veți găsi util să memorați câteva, cum ar fi cele pentru cele patru molecule de mai sus, plus cele pentru moleculele de hidrogen (H2), azot (N2) și oxigen (O2). Acest lucru vă va ajuta la citirea și scrierea acestor formule chimice fără a vă referi continuu la secțiunile anterioare.
Acum veți analiza reacțiile care implică elementele hidrogen, carbon și oxigen și compușii metan, apă și dioxid de carbon.
Hidrogenul va reacționa cu oxigenul atunci când este aprins (este destul de exploziv) pentru a forma apă. Pentru a scrie o astfel de reacție în termenii unei ecuații chimice, substanțele care suferă reacția se pun în stânga, iar substanțele care sunt produse în reacție se pun în dreapta. Reactivii din stânga sunt legați de produșii din dreapta printr-o săgeată.
Ecuația poate fi scrisă ca o ecuație verbală „hidrogenul și oxigenul fac apă” sau, folosind puțină stenogramă chimică, poate fi scrisă sub forma:

unde săgeata înseamnă „merge la”.
Acum, încercați să folosiți stenograma chimică pentru a scrie ecuația. Înlocuind simbolurile în cuvântul ecuație rezultă:

Ecuația arată că reactanții din stânga săgeții se transformă în produsul din dreapta. Cu toate acestea, există ceva în neregulă cu această ecuație. Puteți vedea ce este în neregulă uitându-vă la figura 21, unde reactanții și produsele sunt prezentate sub formă de diagramă.
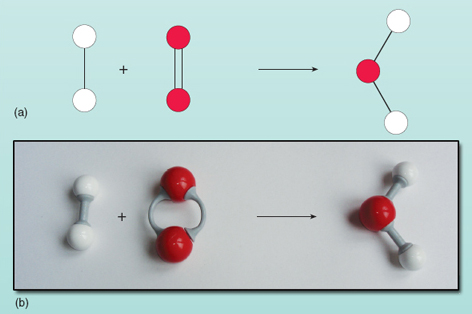
Contând numărul de atomi de pe fiecare parte a ecuației se observă că există doi atomi de oxigen în stânga față de unul în dreapta. Numărul de atomi de oxigen de pe ambele părți ale ecuației trebuie să fie egal – aceștia nu pot apărea și dispărea în mod magic în timpul unei reacții. Nu este posibil să se schimbe compoziția moleculei de apă din dreapta ecuației, deoarece molecula de apă există ca un grup de doi atomi de hidrogen și un atom de oxigen, toți legați între ei. Fiecare moleculă de oxigen furnizează doi atomi de oxigen, deci va forma întotdeauna două molecule de apă, cu condiția să existe două molecule de hidrogen (fiecare fiind o unitate de doi atomi) care să reacționeze cu ea. Astfel, sunt necesare două molecule de hidrogen și o moleculă de oxigen pentru a obține două molecule de apă. Reacția este exprimată cu acuratețe prin:

Există acum același număr de fiecare tip de atom de ambele părți ale ecuației: ecuația chimică este echilibrată, așa că acum putem înlocui săgeata cu un semn de egalitate.
O ultimă ordine pentru a evita repetarea moleculelor de hidrogen din stânga ecuației și a moleculelor de apă din dreapta este de a le reprezenta prin 2H2 în loc de H2 + H2. Astfel, ecuația chimică echilibrată devine:

Acest lucru este prezentat schematic în figura 22.

Ecuațiile chimice arată într-un mod foarte concis nu numai ce atomi și molecule reacționează împreună pentru a forma produșii, ci și câte din fiecare tip de atom și moleculă sunt implicate. Este important de reținut că numărul din fața unei molecule înseamnă numărul moleculei respective. De exemplu, 3H2O înseamnă trei molecule de apă, dând un total de șase atomi de hidrogen și trei de oxigen.
Ecuațiile chimice trebuie să se echilibreze; numărul de atomi din fiecare tip de element de pe ambele părți ale ecuației trebuie să fie egal.
Știi acum cum să „citești” sau să interpretezi o ecuație chimică – și cum reprezintă aceasta un proces chimic. Cu toate acestea, chimiștii sunt, de asemenea, foarte pricepuți să scrie ecuații chimice ca o formă de stenogramă pentru a descrie diverse procese sau reacții chimice. Scrierea ecuațiilor chimice este ca și scrierea în orice limbă străină – necesită practică pentru a deveni fluentă. Cu toate acestea, toți oamenii de știință în devenire trebuie să înceapă de undeva, iar secțiunea de mai jos vă arată cum să faceți acest lucru folosind o reacție chimică foarte cunoscută. Dacă doriți să verificați dacă trebuie să studiați această secțiune, încercați mai întâi întrebarea 20.
.