Dezbatere în reacții chimice
În acest capitol, vom învăța despre unele reacții în care etapele cheie implică deplasarea electronilor unici. Este posibil să vă amintiți, încă de la secțiunea 6.1A, că mișcarea unui singur electron este reprezentată de o săgeată „cârlig de pește” cu o singură bară (spre deosebire de cunoscutele săgeți cu două bare pe care le-am folosit de-a lungul cărții pentru a arăta mișcarea a doi electroni).

Mecanismele cu un singur electron implică formarea și reacția ulterioară a unor specii de radicali liberi, intermediari foarte instabili care conțin un electron neperecheat. Vom învăța în acest capitol cum se formează adesea radicalii liberi din scindarea homolitică, un eveniment în care cei doi electroni dintr-o legătură covalentă care se rupe se deplasează în direcții opuse.

(În schimb, în esență, toate reacțiile pe care le-am studiat până acum implică evenimente de rupere a legăturii în care ambii electroni se deplasează în aceeași direcție: aceasta se numește scindare heterolitică).
Vom învăța, de asemenea, că multe mecanisme cu un singur electron iau forma unei reacții radicale în lanț, în care un radical determină formarea unui al doilea radical, care la rândul său determină formarea unui al treilea radical și așa mai departe.
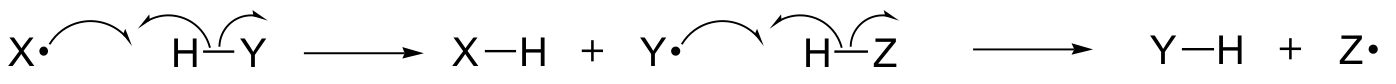
Reactivitatea ridicată a speciilor de radicali liberi și capacitatea lor de a iniția reacții în lanț este adesea benefică – vom învăța în acest capitol despre reacțiile de polimerizare radicalară care formează materiale utile, cum ar fi plexiglasul și țesătura din polipropilenă. Vom învăța, de asemenea, despre reacțiile radicale care sunt dăunătoare, cum ar fi degradarea ozonului atmosferic de către freon și daunele oxidative provocate de speciile de radicali liberi asupra lipidelor și ADN-ului din corpul nostru. În cele din urmă, vom vedea cum unele enzime folosesc metale legate pentru a cataliza reacții de înaltă e
Geometria și stabilitatea relativă a radicalilor de carbon
În calitate de chimiști organici, suntem interesați în special de intermediarii radicali în care electronul nepereche rezidă pe un atom de carbon. Dovezile experimentale indică faptul că cele trei legături dintr-un radical de carbon au o geometrie plană trigonală și, prin urmare, se consideră că carbonul este hibridizat sp2, electronul neîmperecheat ocupând 2pzorbitalul perpendicular, nehibridizat. Contrastând această imagine cu intermediarii carbocation și carbanion, care sunt amândoi de asemenea trigonal planari, dar ai căror orbitali 2pz conțin zero, respectiv doi electroni.

Tendința de stabilitate a radicalilor de carbon este paralelă cu cea a carbocationilor (secțiunea 8.4B): radicalii terțiari, de exemplu, sunt mai stabili decât radicalii secundari, urmați de radicalii primari și de cei metilici. Acest lucru ar trebui să aibă un sens intuitiv, deoarece radicalii, la fel ca și carbocationii, pot fi considerați deficitari în electroni și, prin urmare, sunt stabilizați de efectele donatoare de electroni ale grupărilor alchilice din apropiere. Radicalii benzilici și alilici sunt mai stabili decât radicalii alchilici datorită efectelor de rezonanță – un electron neîmperecheat poate fi delocalizat pe un sistem de legături pi conjugate. Un radical alilic, de exemplu, poate fi imaginat ca un sistem de trei orbitali 2pz paraleli care împart trei electroni.
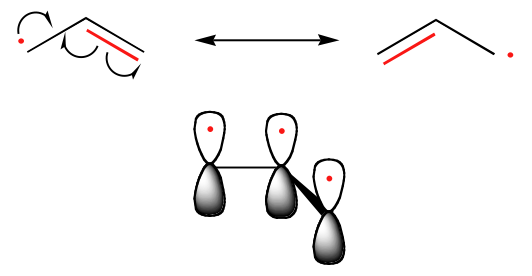
Tendințe în stabilitatea radicalilor
Alilic & Benzlic > 3o > 2o > 1o > Metil

În această moleculă, stabilizarea de rezonanță deja extinsă este sporită și mai mult de capacitatea atomilor de clor de a proteja centrul radicalului de reactivii externi. Radicalul se află, într-un anumit sens, în interiorul unei „cuști” protectoare.
Organic Chemistry With a Biological Emphasis de Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)
.