- Trióxido de enxofre Propriedades Químicas,Usos,Produção
- Propriedades Químicas
- Propriedades físicas
- Usos
- Métodos de produção
- Descrição Geral
- Air & Reações da água
- Perfil de reatividade
- Perigo
- Perigo para a saúde
- Perigo de incêndio
- Perfil de segurança
- Potencial Exposição
- armazenamento
- Transporte
- Incompatibilidades
- Descarte de resíduos
Trióxido de enxofre Propriedades Químicas,Usos,Produção
Propriedades Químicas
Trióxido de enxofre, S03, também conhecido como anidrido sulfúrico, agulhas ou polímero, existe em uma série de modificações que diferem em espécies moleculares e na forma cristalina. Tem uma modificação branca, semelhante ao gelo, que derrete a 16°C (61°F) e duas outras formas semelhantes a bestos que derretem às temperaturas mais elevadas de 33 e 62°C (90 e 144°F). A forma líquida ou gasosa incolor tem vapores irritantes e tóxicos e ferve a 45°C (112°F).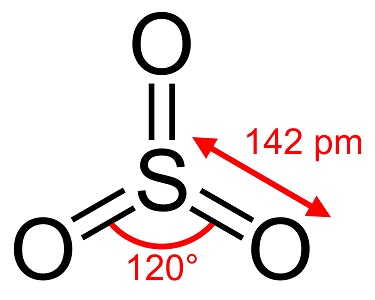
Trióxido de enxofre é uma substância altamente reativa, um agente oxidante forte e um risco de incêndio. Ele reage com óxidos metálicos para formar sulfatos e com água para formar ácido sulfúrico. O trióxido de enxofre é usado para a sulfonação.
Propriedades físicas
Líquido incolor à temperatura ambiente e pressão atmosférica; fumos no ar.
Trióxido de enxofre tende a polimerizar, particularmente na presença de vestígios de água ou ácido sulfúrico. A taxa de sua polimerização, no entanto, diminui muito à medida que seu ponto de congelamento é aproximado. O trióxido de enxofre sólido (polimérico) existe em três fases polimórficas: modificações alfa, beta e gama.
A fase alfa é composta de agulhas tipo gelo com estrutura polimérica reticulada. Ela derrete a 62,3°C e tem uma pressão de vapor de 73 torr a 25°C.
A fase beta é uma alotrópica metastable com agulhas brancas, tipo amianto, lustrosas consistindo de moléculas poliméricas, derretendo a 32,5°C, e com pressão de vapor 344 torr a 25°C.
A modificação gama a temperaturas comuns pode existir na forma sólida ou líquida. Na forma sólida é uma massa de gelo coloidal que derrete a 16,8°C. Na forma líquida tem uma densidade de 1,9224 g/mL, fervendo a 44,8°C. Tem uma pressão de vapor de 433 torr a 25°C. A fase gama consiste em trimer cíclico e moléculas de monômeros. Quando o trióxido de enxofre sólido funde, ele converte para sua fase gama que em solidificação muda para modificação alfa.
A temperatura crítica de SO3 é 217,8°C; pressão crítica 80,97 atm; densidade crítica 0,63 g/cm3; a constante dielétrica do líquido SO3 a 18°C é 3,11,
Trióxido de enxofre dissolve em água formando ácido sulfúrico e gerando grande calor.
Usos
Trióxido de enxofre é usado como intermediário na fabricação de ácido sulfúrico e oleum para sulfonação, em particular, de corantes e corantes, e para a produção de ácido nítrico anidro e explosivos. O trióxido de enxofre sólido é comercializado sob os nomes Sulfano e Triosul, e é utilizado principalmente para a sulfonação de ácidos orgânicos. O tetrafluoreto de enxofre é um agente fluorinizante. O hexafluoreto de enxofre serve como isolante gasoso em instalações elétricas de alta tensão. O fluoreto de sulfureto de enxofre é utilizado como insecticida e fumigante.
Sulfonação de compostos orgânicos, especialmente detergentes não iónicos, colectores de energia solar. Geralmente é gerado na planta onde deve ser utilizado.
Métodos de produção
O trióxido de enxofre é produzido como intermediário na fabricação de ácido sulfúrico pelo processo de contato (Ver Ácido Sulfúrico). O processo envolve a oxidação catalítica do dióxido de enxofre para trióxido.
Trióxido de enxofre é preparado em laboratório aquecendo o ácido sulfúrico fumante, condensando seus vapores, e coletando em um recipiente frio. Quando os vapores são condensados abaixo de 27°C na presença de traços de umidade, todas as três fases polimórficas do SO3 são produzidas. Elas podem ser separadas por destilação fracionada. A condensação dos vapores acima dos 27ºC forma a variedade líquida de trióxido de enxofre gama.
Descrição Geral
Trióxido de enxofre, é um sólido cristalino incolor a branco, que se evaporará no ar. É frequentemente enviado com inibidor para prevenir a polimerização. O trióxido de enxofre reage violentamente com a água para formar ácido sulfúrico com a liberação de calor. O trióxido de enxofre é corrosivo para os metais e tecidos. O trióxido de enxofre causa queimaduras nos olhos e na pele. A ingestão causa queimaduras graves no esófago bucal e no estômago. O vapor é muito tóxico por inalação. O trióxido de enxofre é um risco de incêndio quando em contacto com materiais orgânicos, tais como madeira, algodão, painéis de fibra, etc.
Air & Reações da água
Combina com água com força explosiva, formando ácido sulfúrico devido à sua acidez O trióxido de enxofre carboniza a maioria das substâncias orgânicas. Ao ser exposto ao ar, o trióxido de enxofre absorve rapidamente a humidade, emitindo fumos brancos densos.
Perfil de reatividade
A reação do trióxido de enxofre e difluoreto de oxigênio é muito vigorosa e ocorrem explosões se a reação é realizada na ausência de um solvente . A reacção do trióxido de enxofre em excesso com o tetrafluoroetileno provoca a decomposição explosiva em fluoreto de carbonilo e dióxido de enxofre . A reação do ácido perclórico anidro com trióxido de enxofre é violenta e acompanhada pela evolução de calor considerável (Pascal 16:300 1931-34). O trióxido de enxofre líquido reage violentamente com o cloreto de nitrilo, mesmo a 75° C. A reação do trióxido de enxofre e do óxido de chumbo causa uma luminescência branca . A combinação de iodo, piridina, trióxido de enxofre e formol desenvolveu um gás sobre pressurização após vários meses. Isto é devido à lenta formação de ácido sulfúrico, desde a água externa ou desidratação do formol até ao cianeto de hidrogénio.
Perigo
Oxidante, risco de incêndio em contato com materiais orgânicos, um aumento explosivo na pressão de vapor ocorre quando a forma α derrete. As anidridecombinas com água, formando ácido sulfúrico e desenvolvendo calor. Altamente tóxico, forte irritação dos tecidos.
Perigo para a saúde
Trióxido de enxofre é altamente tóxico. É um irritante e corrosivo das membranas mucosas. É venenoso se inalado ou engolido. O contacto provoca queimaduras graves na pele e nos olhos.
Perigo de incêndio
Risco de incêndio em contato com materiais orgânicos. Um aumento explosivo da pressão de vapor ocorre quando a forma alfa derrete. Combina com água com violência explosiva, formando ácido sulfúrico. Pode incendiar outros materiais combustíveis (madeira, papel, óleo, etc.). Podem acumular-se gases venenosos inflamáveis em tanques e carros-tremonha. O escoamento para o esgoto pode criar risco de incêndio ou explosão. Forma ácido sulfúrico em contacto com a água. Evitar água e materiais orgânicos. Ao ser exposto ao ar, o trióxido de enxofre absorve a humidade e emite fumos brancos densos.
Perfil de segurança
Veneno por inalação. Efeitos sistémicos humanos por inalação: tosse e outras alterações pulmonares e olfactivas. Um irritante corrosivo para a pele, olhos e mucosas. Reação violenta com O2F2, PbO, NClO2, HClO4, P, tetrafluoretileno, acetonitrilo, ácido sulfúrico, dimetil sulfóxido, dioxano, água, difenilmercúrio, formamida, iodo, piridina, óxidos metálicos. Reage com vapor para formar vapores corrosivos e tóxicos de ácido sulfúrico. Quando aquecido para decomposição, emite fumos tóxicos de SO,. Ver também ÁCIDO SULFÚRICO.
Potencial Exposição
Trióxido de enxofre é usado como agente sulfatante e sulfonante para detergentes, aditivos para óleos lubrificantes e outros compostos orgânicos; em coletores de energia solar. Também é usado como intermediário na fabricação de ácido sulfúrico e na fabricação de explosivos.
armazenamento
A pressão de vapor do trióxido de enxofre aumenta rapidamente com o aumento das temperaturas e, quando a forma α derrete, o aumento da pressão é explosiva; consequentemente, os recipientes de transporte e armazenamento devem resistir a pressões de 10 a 15 atm. O trióxido de enxofre reage vigorosa e altamente exotermicamente com a água para produzir ácido hidrosulfúrico. Quando exposto ao ar úmido, ele forma uma névoa de ácido sulfúrico que eventualmente preenche todo o espaço disponível; ele também corrói os metais. É um poderoso agente oxidante e, na fase líquida, carboniza os materiais orgânicos.
Transporte
UN1829 Trióxido de enxofre, estabilizado, classe Hazard: 8; Etiquetas: 8-Corrosivo, 6.1-Perigo de Inalação Elevado, Zona de Risco de Inalação B.
Incompatibilidades
Combustível e Corrosivo. Um oxidante forte. Reage violentamente com água, vapor ou humidade, libertando ácido hidrossulfúrico corrosivo. Reações violentas ocorrem no contato com bases fortes; ácidos fortes, metais quimicamente ativos; agentes redutores; metal finamente dividido; cianetos, nitratos, picratos, fulminatos, cloratos, sulfetos, carbonetos, fósforo, difluoreto de oxigênio, óxido de bário; óxido de chumbo; difenil mercúrio; álcoois, cloreto de nitrilo; acetonitrila, dioxano, tetrafluoroetileno.
Descarte de resíduos
Devolver ao fornecedor cilindros de gás comprimido recarregáveis. Os cilindros não-recarregáveis devem ser descartados de acordo com os regulamentos locais, estaduais e federais. Permitir que o gás remanescente se desprenda lentamente para a atmosfera em uma área não confinada ou exaustor. Os cilindros do tipo recarregável devem ser devolvidos ao fornecedor original com quaisquer tampas de válvula e tampões de saída fixados e tampas de proteção de válvula no lugar.