Propriedades Gerais dos Sais
Salgumas das propriedades características dos sais são:
- Pontos de fusão e de ebulição: Os sais são na sua maioria sólidos que derretem bem como ferver a altas temperaturas.
- Solubilidade em água: Os sais são geralmente solúveis em água. Por exemplo, cloreto de sódio, sulfato de potássio, nitrato de alumínio, carbonato de amônio, etc., são sais solúveis enquanto cloreto de prata, cloreto de chumbo, carbonato de cobre, etc., são insolúveis em água.
- Água de cristalização: Geralmente, os sais são encontrados como cristais com moléculas de água presentes neles. Esta água é chamada de água de cristalização e tais sais são chamados de sais hidratados.
Por exemplo, o cristal de sulfato de cobre tem cinco moléculas de água para cada molécula de sulfato de cobre. Isto é escrito como CuSO4.5H2O. Esta água de cristalização dá ao cristal a sua forma. Também dá cor a alguns cristais. No aquecimento, os sais hidratados perdem sua água de cristalização e, como resultado, os cristais perdem sua forma e cor e mudam para uma substância em pó.
Os sais hidratados que perderam sua água de cristalização são chamados de sais anidros.
Quando o sulfato de cobre hidratado é aquecido, ele dá moléculas de água para formar sulfato de cobre anidro em pó branco. Ao adicionar água, esta substância pode se converter novamente em uma solução hidratada de sulfato de cobre.
Pessoas também perguntam
- Classificação de Sais
- Usos de diferentes sais na vida diária
- Preparação de Sais
- Descrever a preparação de sais solúveis e insolúveis
- Qualitativa Análise de Sais
- Acção de Calor sobre Sais
- Teste de Cátions e Aniões em Soluções Aquosas
- Construção de equações iónicas usando o método de variação contínua
- O que é a estequiometria e porque é que é usada em química?
Propriedades Gerais dos Sais :
1. Reacção com um ácido : Quando um sal reage com um ácido, forma-se outro sal e outro ácido. Por exemplo, quando o cloreto de sódio é aquecido com ácido sulfúrico, o hidrogenossulfato de sódio (a baixa temperatura) e depois o sulfato de sódio (a alta temperatura) são produzidos e o gás cloreto de hidrogénio é evoluído.
2. Reacção com uma base : Um sal reage com uma base para produzir outro sal e outra base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reacção com um metal : Por vezes, uma solução de sal pode reagir com um metal. Por exemplo, quando um prego de ferro é mergulhado numa solução aquosa de sulfato de cobre, o cobre deposita-se na superfície do prego e o sulfato ferroso formado permanece na solução.
CuSO4 + Fe → FeSO4 + Cu
Esta reacção mostra que o ferro é mais reactivo do que o cobre.
Assim, um metal mais reactivo pode deslocar um metal menos reactivo de uma solução do seu sal.
4. Comportamento dos sais em direcção à água :
Quando um sal é dissolvido em água, a solução pode ser neutra, ácida ou alcalina. Isto depende da natureza do sal utilizado.
(i) Um sal normal derivado de um ácido forte e de uma base forte dá uma solução neutra. Por exemplo, as soluções aquosas de NaCl e K2SO4 são neutras ao tornesol.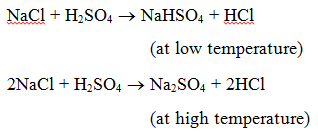
(ii) Um sal normal derivado de um ácido fraco e de uma base forte dá uma solução alcalina. Por exemplo, as soluções aquosas tanto de carbonato de sódio (Na2CO3) como de acetato de sódio (CH3COONa) são alcalinas.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Um sal derivado de um ácido forte e de uma base fraca dá uma solução ácida. Por exemplo, tanto o cloreto de alumínio (AlCl3) como o cloreto de amónio (NH4Cl) produzem soluções ácidas aquosas.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) As soluções de sais ácidos são ácidas até ao tornassol, ou seja, estas soluções tornam o papel de tornassol azul vermelho. Por exemplo, uma solução de hidrogenossulfato de sódio (NaHSO4) torna o papel de tornassol azul vermelho.
Solução de hidrogenocarbonato de sódio (NaHCO3), no entanto, é ligeiramente alcalina.