Você já se perguntou por que os bastões brilhantes (veja a Fig. 1) estão brilhando depois de dobrá-los? Ou porque é que aquelas estrelas de plástico continuam a brilhar à noite depois de as luzes terem sido apagadas? Você pode não ter. No entanto, quer tenha ou não feito a si mesmo essas perguntas, o texto seguinte irá esperançosamente fornecer-lhe respostas e explicações sobre o fenómeno das pulseiras brilhantes, medusas brilhantes, luz negra e muitas mais.

Figure 1. Glow sticks.
Luminescência
Em geral, o brilho que ocorre em todos os fenômenos acima mencionados é chamado de luminescência. Luminescência é a energia libertada por uma substância sob a forma de luz . Vários tipos de luminescência podem ser diferenciados:
- Um exemplo é a quimioluminescência. Durante algumas reacções químicas, a energia é libertada sob a forma de luz. Isto ocorre depois de dobrar uma vareta luminosa. É também a razão para o brilho de animais como medusas ou alguns microorganismos. Neste caso, chama-se bioluminescência .
- Outro tipo é a triboluminescência. Isto pode ser observado quando um envelope auto-adesivo é aberto na escuridão completa ou quando a fita adesiva é desenrolada em uma sala escura. Ao fazê-lo, a energia mecânica é colocada no sistema e serve como ativador do brilho .
- Provavelmente o tipo mais familiar de luminescência é a fotoluminescência. Aqui, a energia é fornecida pela radiação electromagnética, por exemplo através da luz solar ou de uma lâmpada ultravioleta, como em algumas discotecas. Isto causa fenómenos como o brilho contínuo das estrelas de plástico ou o brilho extremo das roupas brancas sob a luz negra. Pode-se diferenciar fluorescência e fosforescência, o que será explicado abaixo .
O que é um estado excitado eletronicamente?
De um modo geral, todos os tipos de luminescência são baseados nos chamados processos fotofísicos. Normalmente, as próprias moléculas são descritas como fluorescentes. Este é o caso de corantes fluorescentes como a fluoresceína ou a curcumina. No entanto, para explicar os processos fotofísicos, é preciso olhar mais de perto para um nível ainda menor que o molecular.
Atomos de diferentes elementos têm um número diferente de elétrons distribuídos em várias conchas e orbitais. Os elétrons são um tipo de partícula elementar. As transições eletrônicas são responsáveis pela luminescência. Quando o sistema absorve energia, os elétrons são excitados e são elevados a um estado energético superior. Antes da excitação, no estado de terra, alguns dos elétrons estão no chamado HOMO (Highest Occupied Molecular Orbital). Depois de alcançarem um estado de excitação, estão no LUMO (Lowest Unoccupied Molecular Orbital) (ver Fig. 2). Como isto funciona exatamente será explicado usando a fotoluminescência como exemplo específico.

Figure 2. Excitação electrónica.
Diferentes estados energéticos de um átomo ou molécula são conhecidos como “níveis energéticos”. Dependendo da molécula e do átomo, os electrões só podem ocupar níveis de energia discretos uma vez que a energia é quantizada, o que significa que a energia só pode ser absorvida e emitida em determinadas quantidades . A diferença entre dois níveis pode ser calculada com a equação 1 (onde E2 é o nível energético mais alto e E1 o mais baixo).
(1) ΔE = E2-E1
Fotões, partículas das quais consiste a radiação electromagnética ou a luz, têm de ter um determinado valor energético para serem capazes de excitar electrões. A energia de um fóton pode ser calculada com a equação 2, onde h é a constante de Planck e ν é a frequência da luz.
(2) Ephoton = hν
A energia de excitação necessária para os elétrons é igual à diferença entre os níveis de energia. Apenas a luz com uma certa energia e, consequentemente, com uma certa frequência e comprimento de onda, é capaz de excitar os electrões. Equalizando as equações 1 e 2, e com a ajuda da equação 3 (onde c representa a velocidade da luz), a frequência e o comprimento de onda necessários podem ser calculados (ver eq. 4) . Em muitos casos, a radiação UV é usada para excitação.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Desactivação dos estados excitados electronicamente
Tantos estados excitados electronicamente são instáveis. Os electrões caem de volta aos seus estados de excitação electrónica. Ao mesmo tempo, a energia de excitação é liberada novamente. Distingue-se entre processos de decaimento radiativos e não radiativos. Na maioria das vezes, a decomposição é não-radiativa, por exemplo, através de relaxamento vibracional, resfriamento com moléculas circundantes, ou conversão interna (IC) . Estes processos serão explicados em detalhes mais tarde.
Por vezes, um decaimento radiativo pode ocorrer em forma de fluorescência e fosforescência. A energia é emitida como radiação eletromagnética ou fótons. A luz emitida tem um comprimento de onda maior e uma energia menor do que a luz absorvida porque uma parte da energia já foi liberada em um processo de decaimento não-radiativo. Esta é a razão pela qual uma emissão no espectro visível pode ser obtida por excitação com radiação ultravioleta não visível. Esta mudança para um comprimento de onda maior é chamada de Stokes shift .
Comparação: Fluorescência vs. Fosforescência
A fluorescência e a fosforescência são emissões espontâneas de radiação electromagnética. A diferença é que o brilho da fluorescência pára logo após a fonte de radiação excitatória ser desligada, enquanto que para a fosforescência pode ocorrer um brilho posterior com durações de frações de um segundo até horas .
Para comparar os processos fotofísicos por trás dos dois fenômenos, há alguns fatos sobre os elétrons que são úteis para a compreensão: Os electrões são partículas que têm um número quântico de spin e um número quântico de spin. Isto pode ter dois valores diferentes, ou seja +1/2 ou -1/2 . Este número é uma propriedade que na verdade não podemos imaginar ou descrever facilmente. É frequentemente comparado com um topo giratório, seja girando no sentido horário ou anti-horário. No entanto, esta descrição não é nem matemática nem fisicamente bastante correcta. Dois elétrons em uma única órbita de um átomo têm spin antiparalelo, que é notado como (↓) .
Fluorescência
No diagrama de Jablonski para fluorescência (veja Fig. 3), o estado de spin S0 singlet spin é o estado de terra dos elétrons, e S1 e S2 são estados de excitação singlet (os estados são usados apenas como exemplo neste texto e não se aplicam necessariamente a certos átomos, moléculas, etc.). Dentro desses estados, existem vários níveis de energia. Quanto mais alto for o nível, mais energia um elétron possui quando está nesse nível. No caso de estados uniparalelos, os elétrons têm giros antiparalelos.

Figure 3. Diagrama Jablonski para fluorescência.
Os elétrons são levantados do estado de terra S0, por exemplo, para um nível de energia do segundo estado excitado S2, quando excitado pela radiação eletromagnética. Após a excitação parar, os elétrons só permanecem nesse estado excitado por um curto período de tempo (ca. 10-15 s) e imediatamente começam a cair de volta para o estado de terra . Ao fazer isso, a energia inicialmente pode ser libertada para o ambiente através de um relaxamento vibracional. Isto significa que a energia térmica é libertada pelo movimento do átomo ou molécula até se atingir o nível mais baixo do segundo estado excitado.
O maior intervalo entre o segundo e o primeiro estado excitado é ultrapassado pela conversão interna. Isso descreve uma transição eletrônica entre dois estados enquanto o giro dos elétrons é mantido. Agora, os electrões podem relaxar ainda mais devido ao relaxamento mais vibracional até atingirem o nível de energia mais baixo do estado S1.
Teoricamente, os electrões podem relaxar ainda mais de forma não-radiativa até atingirem novamente o estado de terra. No entanto, pode acontecer que a última quantidade de energia seja demasiado grande para ser libertada para o meio envolvente, porque as moléculas circundantes não conseguem absorver essa quantidade de energia. Então, ocorre a fluorescência, o que leva a uma emissão de fótons que possuem um determinado comprimento de onda. A emissão dura apenas até que os elétrons estejam de volta ao estado de terra. Como durante todas essas transições o spin dos elétrons é mantido o mesmo, eles são descritos como spin-allowed .
Fosforescência
Para fosforescência, as coisas são um pouco diferentes (ver Fig. 4). Há novamente um estado de terra S0 e os dois estados excitados, S1 e S2. Além disso, há um estado excitado T1 trigémeo que se encontra energeticamente entre o estado S0 e S1. Os elétrons novamente têm giros antiparalelos no estado de terra.
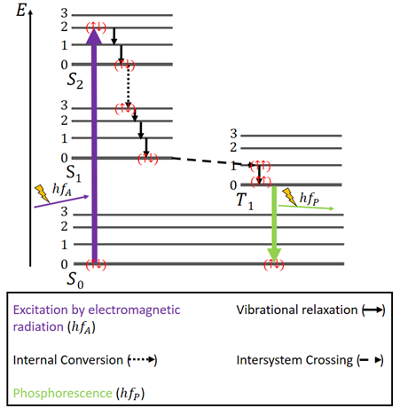
Figure 4. Diagrama Jablonski para fosforescência.
Excitação acontece da mesma forma que na fluorescência, nomeadamente através da radiação electromagnética. A liberação de energia através de relaxamento vibracional e conversão interna, mantendo o mesmo spin, é a mesma aqui também, mas apenas até o estado S1 ser alcançado.
Junto com os estados singlet, existe um estado triplet e a chamada intersistema de cruzamento (ISC) pode ocorrer uma vez que o estado T1 é energeticamente mais favorável do que o estado S1. Esta travessia, tal como a conversão interna, é uma transição electrónica entre dois estados excitados. Mas ao contrário da conversão interna, a ISC está associada a uma inversão de spin de singlet para triplet. Os elétrons no estado triplet têm giros paralelos, que é notado como () . Este processo ISC é descrito como “spin-forbidden”. Não é completamente impossível – devido a um fenómeno chamado “spin-orbit coupling” – no entanto, é bastante improvável .
No estado T1, também é possível a decomposição não-radiativa. Contudo, uma transição entre o nível de energia mais baixo do estado triplet e o estado S0 não é prontamente possível, porque essa transição é spin-forbidden, também. Ainda assim, ela pode acontecer de qualquer forma com uma pequena possibilidade. Causa uma emissão de fotões bastante fraca porque o spin dos electrões tem de ser invertido novamente. A energia fica presa neste estado durante algum tempo e só pode ser libertada lentamente. Depois de toda a energia ter sido libertada, os electrões voltam ao estado de terra .
Conclusão
Os processos de spin-allowed e -forbidden servem de explicação para um brilho de fluorescência imediatamente cessante e para o brilho posterior de fosforescência. A fosforescência geralmente ocorre apenas com moléculas mais “pesadas”, uma vez que o spin tem de ser invertido com a ajuda do acoplamento spin-orbit. Se a radiação electromagnética é emitida, e com que comprimento de onda, depende de quanta energia pode ser libertada de antemão pela decomposição não-radiativa. Depende também das propriedades dos chamados quenchers que são moléculas circundantes e são capazes de absorver maiores quantidades de energia.
Todos os processos que podem levar a uma inibição das decadências radiativas podem causar têmpera por fluorescência. Exemplos são processos de decaimento não-radiativos, mas também a destruição da molécula fluorescente. A eficiência quântica descreve a eficiência do processo e é definida como a razão entre os fótons absorvidos e emitidos . Esta propriedade é diferente para cada substância.
Embora este texto focalize a fotoluminescência, os processos fotofísicos são os mesmos para todos os tipos de luminescência .
Aplicações
Além de produtos como paus brilhantes, a fluorescência e a fosforescência são utilizadas de muitas outras formas. Outros exemplos são os postes de guia que levam a uma saída de emergência que não necessita de alimentação eléctrica mas que brilha à noite devido à fosforescência. Mesmo as plantas podem ser tornadas fluorescentes: O espinafre pode ser modificado com a ajuda da nanotecnologia para que possa detectar vestígios de substâncias explosivas nas águas subterrâneas. As folhas contêm nanotubos de carbono, aos quais os nitroaromáticos se podem ligar. Se o fizerem, um sinal fluorescente é libertado pela planta e pode ser detectado com câmaras infravermelhas .
O vídeo demonstra diferentes tipos de luminescência. No lado esquerdo, ele mostra a fluorescência da curcumina do corante, que está contida no açafrão-da-índia picante, sob luz UV . A curcumina é dissolvida em álcool para tornar a fluorescência visível.
A aranha plástica e o composto no tubo pequeno são exemplos de fosforescência. O aluminato de estrôncio, que está contido no tubo, é inicialmente excitado pela radiação UV e eventualmente emite luz verde. A causa disto é um doping com elementos como o europium, que torna o composto utilizável como pigmento luminescente.
A flexão do bastão brilhante (no lado direito) inicia uma reacção química entre o peróxido de hidrogénio e um corante e o oxalato de fenilo. Pode ser observada quimioluminescência.
Video 1. Fluorescência, fosforescência e quimiluminescência em comparação.
K. Arnold et al., Chemie Oberstufe (em alemão), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (em alemão), spektrum.de. (acessado em 25 de janeiro de 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (em alemão), chemieunterricht.de 2010. (acedido a 25 de Janeiro de 2017)
Lexikon der Physik: Photophysikalische Prozesse (em alemão), spektrum.de. (acedido a 27 de Janeiro de 2017)
D. Wiechoczek, Chemie mit Curry (em alemão), chemieunterricht.de 2015. (acedido a 27 de Janeiro de 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (em alemão), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (em alemão), chemie.de. (acessado em 27 de janeiro de 2017)
Bohr frequency relation (em alemão), chemgapedia.de. (acessado em 25 de janeiro de 2017)
Ilmenau University of Technology, Practical Course Physical Chemistry II: Physical Chemistry/Microreaction Technology, Fluorescence Quenching Experiment (em alemão), tu-ilmenau.de. (acessado em 27 de janeiro de 2017)
Stokes shift (em alemão), chemie.de. (acedido a 25 de Janeiro de 2017)
Electron spin (em alemão), chemie.de. (acessado em 27 de janeiro de 2017)
Quantum yield (em alemão), chemie.de. (acessado em 27 de janeiro de 2017)
Spinach detecta explosivos em águas subterrâneas (em alemão), Spiegel Online, 1 de novembro de 2016. (acessado em 27 de janeiro de 2017)
D. Weiß, Phosphorescence (em alemão), chemie.uni-jena.de. (acessado em 27 de janeiro de 2017)
 Kim Dreier é aluno do Marianne-Weber-Gymnasium (escola secundária) em Lemgo, Alemanha.
Kim Dreier é aluno do Marianne-Weber-Gymnasium (escola secundária) em Lemgo, Alemanha.