Introduction
O cérebro humano sofre uma maturação extensiva ao longo da vida para facilitar o desenvolvimento cognitivo. A mielinização dos axônios em todo o sistema nervoso é um desses processos cruciais de maturação. No sistema nervoso central (SNC), células gliais chamadas oligodendrócitos estendem muitos processos ao seu ambiente circundante, que concentricamente envolvem a membrana ao redor dos axônios para formar bainhas de mielina. As bainhas de mielina permitem a rápida condução salina dos potenciais de ação, através da localização de canais de Na+ de tensão para curtos espaços entre as bainhas adjacentes (conhecidos como os nós de Ranvier), e agindo como isoladores elétricos. Os eixos que são totalmente mielinizados ao longo do seu comprimento conduzem impulsos muitas vezes mais rápidos que os eixos não mielinizados do mesmo tamanho de secção transversal (Waxman, 1980). Portanto, os circuitos neurais mielinizados conduzem informações muito mais rapidamente do que os circuitos não mielinizados. Os humanos nascem com um SNC praticamente não mielinizado, e a população de oligodendrócitos se expande dramaticamente após o nascimento com mielinização generalizada nos primeiros anos da infância. A mielinização continua até a adolescência e até a idade adulta de uma forma espacialmente temporal característica, correlacionando-se com o surgimento e manutenção do funcionamento adequado dos circuitos. Por exemplo, a maturação da matéria branca (as áreas ricas em mielina do SNC) é concomitante com o desenvolvimento de processos cognitivos da infância, como a velocidade de processamento da informação (Mabbott et al., 2006; Scantlebury et al., 2014). Adicionalmente, a patologia/abnormalidades da mielina são observadas não só na doença desmielinizante Esclerose Múltipla, mas também em várias doenças neurodegenerativas (Kang et al., 2013; Huang et al., 2015) e doenças neurodegenerativas (Takahashi et al., 2011). No entanto, a mielinização dos axônios individuais não é um fenômeno de “tudo ou nada”. Os axônios no SNC apresentam grande variação no número de bainhas da mielina, comprimento da bainha, espessura da bainha e distribuição ao longo de seu comprimento. Muitos padrões diferentes de mielinização existem; por exemplo, axônios com regiões pouco mielinizadas têm sido descritos no córtex juvenil e adulto do rato (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). A modificação de qualquer um destes parâmetros de bainha tem efeitos previsíveis sobre a velocidade de condução do axônio subjacente – portanto, estabelecer um padrão específico de mielinização ao longo de um axônio pode ser particularmente importante para afinar a função do circuito. Por exemplo, os axônios no tronco cerebral auditivo dos gerbos exibem bainhas de mielina progressivamente mais curtas ao longo das regiões distais para assegurar o momento preciso da chegada do sinal para facilitar a localização do som (Ford et al., 2015). Alterações subtis no padrão geral de mielinização ao longo de um axônio (seja através da adição de mielina nova, ou da remodelação da mielina existente) poderiam alterar profundamente o tempo dos impulsos neurais nos circuitos. Se a mielina é adaptável, então modificar tais padrões de mielinização pode representar um poderoso mecanismo na regulação da função do circuito ao longo da vida.
Evidências recentes sugerem que a mielina pode ser adaptável em resposta à atividade do circuito. A imagem do tensor de difusão do cérebro inteiro pode ser usada para medir mudanças amplas na matéria branca rica em mielina ao longo do tempo – tais experimentos em humanos e roedores mostraram que a aprendizagem de uma nova tarefa está correlacionada com alterações na matéria branca em regiões relevantes do cérebro (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Análises de nível celular em modelos animais demonstram que a produção de novos oligodendrócitos mielinizantes é necessária para o aprendizado motor eficiente (McKenzie et al., 2014; Xiao et al., 2016). Atualmente, é levantada a hipótese de que a atividade dos circuitos neurais pode desencadear mudanças na mielina; um extenso conjunto de pesquisas demonstrou que a atividade neuronal pode influenciar a proliferação de células precursoras de oligodendrócitos (OPCs), a diferenciação dos oligodendrócitos e a formação e crescimento das bainhas de mielina. Esta pesquisa, incluindo evidências dos sinais moleculares envolvidos, tem sido extensivamente revista em outros lugares (Fields, 2015; Almeida e Lyons, 2017; Mount e Monje, 2017). A atividade neuronal poderia impulsionar mudanças na mielina que, por sua vez, poderia mudar as velocidades de condução para afinar os tempos subjacentes à função do circuito.
No entanto, ainda não sabemos se ou como a mielinização dos circuitos é regulada dinamicamente ao longo da vida. O trabalho com roedores indica que novos oligodendrócitos são gerados em todo o SNC mesmo na vida adulta (Young et al., 2013), e os OPCs residem dentro do cérebro humano adulto (Chang et al., 2000). A análise de datação por carbono do tecido humano identificou oligodendrócitos nascidos no adulto dentro do córtex, embora as mesmas análises tenham indicado que a maioria dos oligodendrócitos no corpo caloso tem origem na primeira infância (Yeung et al., 2014). Entretanto, os estudos de neuroimagem em humanos que correlacionam alterações estruturais da matéria branca com a aprendizagem de tarefas sugerem que nova mielina pode ser formada ao longo da vida. Tal mielinização prolongada exigiria, em princípio, a produção de oligodendrócitos ao longo da vida, dado que os oligodrócitos mielinizantes individuais têm uma janela de tempo restrita de apenas algumas horas para iniciar a formação de novas bainhas (Watkins et al., 2008; Czopka et al., 2013) e o número de bainhas por oligodrócito parece estável ao longo do tempo (Tripathi et al., 2017). Uma ressalva apontada por Mount e Monje (2017) é que a data de “nascimento” na experiência de datação por carbono (que identifica o ponto de tempo de replicação de DNA durante a divisão celular), reflete a do OPC, não necessariamente o oligodendrócito diferenciado. Isto é importante, dadas as evidências de que os OPCs podem se diferenciar diretamente em oligodendrócitos sem divisão celular, pelo menos em roedores (Hughes et al., 2013). Os OPCs no corpus callosum poderiam se diferenciar diretamente em oligodendrócitos muitos anos após sua divisão em células terminais; assim, o tempo de diferenciação desses novos oligodendrócitos não pode ser determinado pela datação por carbono, e assim Yeung et al. (2014) podem ter subestimado a taxa de produção de oligodendrócitos no cérebro humano adulto. Ainda temos muito a aprender sobre as contribuições relativas da geração de oligodendrócitos e da remodelação da mielina para o desenvolvimento do SNC ao longo da vida.
Para compreender completamente a dinâmica precisa da oligodendrogenese, formação da mielina e remodelação da mielina ao longo de vários estágios da vida, a imagem longitudinal em alta resolução representa a abordagem padrão-ouro. Aqui nós fornecemos uma visão geral dos recentes estudos de imagem in vivo que estão começando a esclarecer a dinâmica da mielinização, o que também nos permitirá começar a entender como tal dinâmica pode impactar a função do circuito neural.
De novo Myelination
Para começar a abordar definitivamente como os oligodendrócitos são gerados e como a mielina é feita e remodelada dinamicamente in vivo, dois estudos recentes utilizaram imagens repetidas de dois fótons do córtex somatosensorial do mouse durante longos períodos de tempo. Hughes et al. (2018) fizeram imagens do córtex de ratos transgênicos com células de linhagem oligodendroglial fluorescentes desde o início da idade adulta, até a meia-idade e velhice (aproximadamente P720). Eles descobriram que a população de oligodendrócitos continua a se expandir e que a densidade de oligodrócitos corticais quase dobra entre os estágios de adulto jovem e de meia-idade (Figura 1A). Isto foi acompanhado por um aumento superior ao dobro no número de bainhas de mielina cortical. Mas como aumenta o número de oligodendrócitos? No desenvolvimento pós-natal precoce muitos oligodendrócitos são produzidos, mas apenas um subconjunto sobrevive e passa a mielinizar axônios (Barres et al., 1992). Isto parece ser semelhante na idade adulta – ao seguir OPCs corticais individuais no córtex adulto por até 50 dias, Hughes et al. (2018) revelaram que a maioria dos oligodendrócitos recém diferenciados sofre morte celular, com apenas 22% sobrevivendo e se comprometendo com a mielinização (Figura 1B). Ainda não se sabe qual a proporção de oligodendrócitos recém diferenciados que são gerados após a divisão OPC versus diferenciação direta. Entretanto, uma vez que os oligodendrócitos se submetem à mielinização, eles permanecem estáveis, sem evidências de oligodendrócitos mielinizantes submetidos à morte celular durante um período de imagem de 50 dias.
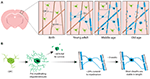
FIGURA 1. Dinâmica dos oligodendrócitos e mielinas no córtex dos mamíferos ao longo da vida. (A) As células precursoras de oligodendrócitos (OPCs) geram continuamente novos oligodendrócitos mielinizantes (OLs) no córtex somatossensorial desde o nascimento até a meia idade. A população de OL então diminui na velhice, acompanhada por uma redução na cobertura de mielina. (B) O rastreamento de linhagem de OPCs individuais mostra que, embora as OLs pré-mielinizantes sejam produzidas continuamente na idade adulta, apenas cerca de 20% sobrevivem para mielinizar. A maioria das bainhas de mielina, uma vez formadas, são estáveis em comprimento durante um período prolongado de tempo, indicando que normalmente há muito pouca remodelação da mielina existente. Resumo dos dados de Hill et al. (2018) e Hughes et al. (2018).
Similiarmente, Hill et al. (2018) usaram repórteres transgênicos de oligodendrócitos e a técnica de microscopia de reflexão confocal livre de rótulos (SCoRe) para imagearem mielina ao longo dos axônios (Schain et al., 2014) no córtex somatosensorial de ratos jovens, adultos jovens, de meia-idade e de idade avançada (P950). Eles também descobriram que o número de oligodendrócitos continua a se expandir na idade adulta até P650, e que os oligodrócitos são estáveis na meia-idade por até 80 dias de imageamento. Eles descobriram que a mielinização do córtex também atinge o pico na meia-idade em P650, e que a densidade de oligodendrócitos cai significativamente desde seu pico (em P650) até a idade muito avançada (P950) (Figura 1A). Isto foi refletido em uma redução da cobertura de mielina dos eixos corticais da camada I entre P650 e P950. A sobrevivência dos oligodendrócitos a longo prazo pode variar entre diferentes partes do SNC. Tripathi et al. (2017) rotularam oligodendrócitos mielinizantes em P60 em ratos e depois contaram quantas células rotuladas sobreviveram até P605 em várias regiões do SNC. Eles descobriram que na medula espinhal e no córtex motor, 60-70% das células rotuladas com P60 sobreviveram, enquanto no corpo caloso, mais de 90% das células rotuladas com P60 sobreviveram. A redução do número de oligodendrócitos e mielinização em certas regiões do SNC com a idade levanta questões intrigantes sobre o papel da perda de mielina no declínio cognitivo associado à idade. A análise MRI mostra que a microestrutura da matéria branca se correlaciona com a inteligência dos fluidos (Ritchie et al., 2015), mas também que essa microestrutura da matéria branca se deteriora com o aumento da idade (Cox et al., 2016). A perda subsequente de mielina associada à idade pode levar a uma redução da função cognitiva devido à desregulação dos circuitos mielinizados.
A geração de novos oligodendrócitos (e subsequentemente nova mielina) no córtex adulto pode ser responsiva à atividade dos circuitos? Pesquisas anteriores mostraram que a redução da entrada sensorial pela remoção dos bigodes dos ratos leva a uma redução da oligodendrogenese no córtex somatosensorial (Hill et al., 2014). Para investigar mais a fundo, Hughes et al. (2018) forneceram aos ratos adultos (P365) estimulação sensorial durante 3 semanas, pendurando contas nas gaiolas dos animais para estimular repetidamente seus bigodes e, assim, o córtex somatosensorial. Através de imagens do córtex somatosensorial antes e depois das 3 semanas, eles demonstraram que a estimulação sensorial aumenta o número de oligodendrócitos, potencialmente devido ao aumento da sobrevivência de células recém diferenciadas. Kougioumtzidou et al. (2017) forneceram mais evidências de que a atividade dos circuitos pode ser importante na regulação da sobrevivência celular – eles demonstraram que a perda das subunidades receptoras da AMPA 2, 3 e 4 nos OPCs leva à redução da sobrevivência dos oligodendrócitos. Isto sugere que a mielinização de novo poderia ser modulada pela atividade do circuito cortical ao longo da vida, talvez para afinar a função desses mesmos circuitos.
Muitas questões permanecem por abordar: qual é o efeito da oligodendrogenese e da mielinização de novo na função real do circuito? A atividade neuronal aumenta a sobrevivência a longo prazo dos oligodendrócitos mielinizantes? É possível que a perda de oligodendrócitos na velhice seja devida à redução da atividade neuronal associada à idade, que pode, por sua vez, afetar a sobrevivência global dos oligodendrócitos. Alternativamente, pode ser que os oligodendrócitos tenham um tempo de vida limitado independente da atividade neuronal (seja intrinsecamente programada ou influenciada por outros sinais extrínsecos associados ao envelhecimento). Em ambos os casos, a estimulação do circuito pode ajudar a aliviar a perda de mielina associada à idade, promovendo a sobrevivência dos oligodendrócitos existentes ou estimulando a produção de novos oligodendrócitos. Isto, por sua vez, poderia ter implicações significativas no tratamento e prevenção do declínio cognitivo associado à idade.
Oligodendrogênese mediada por atividade não se restringe ao córtex somatossensorial – ratos adultos jovens em aprendizagem motora também mostram um aumento no número de oligodendrócitos recém diferenciados no córtex motor (Xiao et al., 2016). E quanto a outras áreas do SNC? Muitos axônios corticais projetam-se através do corpus callosum e, portanto, a estimulação dos circuitos corticais poderia sinalizar tanto para os OPCs corticais quanto para os OPCs calosais. Dois estudos com roedores demonstraram que a estimulação dos neurônios corticais induz a oligodendrogenese dentro do corpus callosum. Gibson et al. (2014) estimulam optogeneticamente os neurônios de projeção da camada V no córtex pré-motor, encontrando um aumento na proliferação de OPC tanto no córtex pré-motor quanto no corpus calosum. Isto levou a um aumento no número de oligodendrócitos e na espessura da bainha 4 semanas após a estimulação. Mais recentemente, Mitew et al. (2018) usaram Designer Receptors Exclusivamente Activated by Designer Drugs para estimular os neurônios somatosensoriais da camada 2/3, e também observaram aumento da proliferação de OPC, oligodendrogênese e bainhas de mielina mais espessas no corpus callosum tanto em camundongos jovens quanto adultos. Eles também demonstraram que novos oligodendrócitos formam preferencialmente bainhas de mielina nos axônios ativos. Isto indica que a mielinização induzida pela atividade de novo mielinização pode, em princípio, ter como alvo os axônios/circuitos ativos. Ainda não se sabe quanto tempo as mudanças duradouras na mielina em resposta à atividade neuronal podem ser. A sobrevivência a longo prazo das células mielinizadoras observada por Tripathi et al. (2017), Hill et al. (2018) e Hughes et al. (2018) sugere que uma vez que um oligodendrócito forma bainhas de mielina é provável que ele sobreviva mesmo que os níveis de atividade neuronal retornem à linha de base. Se as próprias bainhas de mielina mudam uma vez que a atividade neuronal retorna aos níveis normais requer mais investigação da dinâmica individual da bainha, o que é discutido abaixo.
Assim, é possível que a mielinização de novo ao longo da vida possa ocorrer em muitas regiões do SNC, onde os axônios adequados para a mielinização têm espaço não mielinizado suficiente. Entretanto, ainda não está claro até que ponto a oligodendrogenese continua em diferentes áreas do cérebro humano adulto. A análise de datação por carbono sugere que a maioria dos oligodendrócitos no trato corpus callosum são gerados na primeira infância (Yeung et al., 2014). A análise imunohistoquímica do tecido cerebral humano usando um novo marcador para oligodendrócitos recém diferenciados (BCAS1) mostra novos oligodendrócitos no córtex frontal mesmo além da meia-idade, mas muito poucos oligodrócitos novos em matéria branca após a terceira década de vida (Fard et al., 2017). Esta diferença de oligodendrócitos entre espécies pode ser resultado da escala. Dados de Hughes et al. (2013) sugerem que os oligodendrócitos são gerados em enorme excesso, com poda contínua de quase 80% das células. Dado o custo energético de tal processo, será este mecanismo sustentável ao longo da vida num órgão do tamanho do cérebro humano? Talvez no cérebro humano haja uma superprodução limitada de oligodendrócitos, devido a uma necessidade de mielinização mais prolongada do grande SNC, ou porque sinais como a atividade neuronal estimulam os OPCs a se diferenciarem em oligodendrócitos como e quando necessário.
Mielin Remodelação
A remodelação das bainhas de mielina existentes poderia alterar as propriedades de condução sem a necessidade de gerar novos oligodendrócitos ou mielina. A alteração do comprimento das bainhas de mielina existentes poderia alterar a cobertura de mielina ao longo de um axônio e a distância entre os nós de Ranvier (o que teria ambos impacto nas velocidades de condução). Além disso, mesmo a remodelação muito sutil da mielina poderia alterar os comprimentos dos próprios nós. Foi recentemente demonstrado que o comprimento dos nós pode variar muito no nervo óptico e no córtex, e que mudar o comprimento dos nós ao longo de um axônio também pode, em princípio, alterar significativamente a velocidade de condução (Arancibia-Cárcamo et al., 2017). Se as mudanças no nó de Ranvier são impulsionadas principalmente pela mielinização ou reorganização do próprio axônio ainda não foi determinado.
Both Hill et al. (2018) e Hughes et al. (2018) realizaram estudo longitudinal de bainhas individuais de mielina no córtex somatosensorial do mouse por várias semanas para avaliar se os comprimentos das bainhas são regulados dinamicamente. Hill et al. (2018) descobriram que, no início da vida adulta (P90-120), embora algumas bainhas apresentem extensão ou encolhimento, 81% das bainhas observadas eram estáveis. Mais bainhas podem se tornar estáveis em comprimento com a idade; Hughes et al. (2018) seguiram bainhas em animais mais velhos (P365) e viram que 99% das bainhas permaneceram estáveis durante 3 semanas (Figura 1B).
Estabilidade similar do comprimento da bainha também foi descrita em outro lugar; Auer et al. (2018) usaram zebrafish larval para investigar se bainhas individuais podem mudar em comprimento ao longo do tempo realizando imagens ao vivo de bainhas de mielina fluorescentemente rotuladas. Eles descobriram que as bainhas individuais sofrem um crescimento rápido mas variável nos primeiros dias após a formação, antes de estabilizarem o comprimento de suas bainhas. Uma vez estabilizadas, as bainhas só continuam a crescer para acomodar o crescimento geral do animal.
Por que algumas bainhas no córtex mudam de comprimento, enquanto outras não? Isto pode refletir a diversidade nas exigências de circuitos neurais distintos. A diversidade axonal tem sido observada durante a mielinização inicial na medula espinhal do zebrafish, onde alguns axônios usam a liberação sináptica da vesícula para regular o número e comprimento da bainha da mielina enquanto outros não (Koudelka et al., 2016). Isto levanta a intrigante hipótese de que apenas alguns axônios são capazes de regular a mielina através de sinais relacionados à atividade. Hughes et al. (2018) descobriram que seu paradigma de estimulação sensorial não aumenta a proporção de bainhas dinâmicas no córtex somatossensorial. Entretanto, uma análise mais detalhada da diversidade de subtipos de axônios acoplada ao estudo longitudinal da dinâmica do comprimento da bainha poderia confirmar se a remodelação do comprimento da bainha é específica para certos circuitos.
A estabilidade do comprimento da bainha reflete uma incapacidade de remodelação das bainhas? Experiências no zebrafish sugerem que a remodelação do comprimento da bainha pode ser induzida quando o perfil de mielinização de um axônio é interrompido. Auer et al. (2018) ablacionaram oligodendrócitos simples e, portanto, bainhas escassamente removidas ao longo dos axônios. Eles descobriram que quando uma única bainha de mielina é perdida em um axônio totalmente mielinizado, as bainhas vizinhas poderiam reiniciar um crescimento rápido para cobrir a lacuna não mielinizada. Em vários casos uma nova bainha de mielina se formaria no lugar de sua predecessora e poderia até mesmo empurrar para trás contra as bainhas vizinhas invasoras para restaurar o padrão original de mielinização (Figura 2A). Portanto, às vezes um padrão específico de mielinização é preferencialmente mantido, mesmo após a ruptura da mielina. Isto pode ser para sustentar as propriedades de condução otimizada do axônio subjacente. Auer et al. (2018) observaram axônios esparsamente mielinizados no zebrafish larval, como previamente identificado no córtex do roedor. Curiosamente, eles descobriram que ao ablação de bainhas únicas em axônios tão esparsamente mielinizados, uma nova bainha formou praticamente no mesmo lugar que a bainha ablacionada, mesmo ao longo de um trecho não mielinizado do axônio (Figura 2B). Assim, os padrões de mielinização ao longo dos axônios esparsamente mielinizados também parecem ser mantidos de forma estável em zebrafish, como sugerido por Hill et al. (2018) em roedores. A função dos perfis de mielinização esparsa permanece desconhecida. Tais padrões podem permitir uma afinação mais dinâmica da função de um único axônio ao longo do tempo, embora também seja possível que tais folgas não mielinizadas possam facilitar a mielinização gradual para manter tempos de condução consistentes dentro dos circuitos, à medida que o animal cresce e/ou o comprimento dos axônios muda.
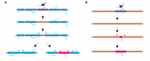
FIGURA 2. A remodelação de mielina pode ocorrer in vivo. (A) A ablação de bainhas únicas em um axônio totalmente mielinizado pode induzir o rápido crescimento das bainhas vizinhas para cobrir a fenda. Esta lacuna pode ser coberta inteiramente pelas bainhas vizinhas, ou o perfil de mielinização original pode ser restaurado com a adição de uma nova bainha. (B) A ablação de uma bainha em um axônio mielinizado esparsamente é seguida pela formação de uma nova bainha de mielina de tamanho e localização idênticos aos da bainha predecessora ablacionada. Resumo dos dados de Auer et al. (2018).
As bainhas estáveis de mielina em mamíferos também têm esta capacidade de remodelação quando o padrão de mielinização é interrompido? Outros estudos longitudinais acoplados à desmielinização são necessários para responder a esta pergunta. É possível que tal remodelação não seja induzida pela atividade neuronal, mas é um mecanismo compensatório para a perda de mielina. A perda de oligodendrócitos associada à idade pode desencadear a remodelação das bainhas sobreviventes para cobrir porções desnudadas de axônio e, portanto, ajudar a manter a função do circuito. A imagem ao vivo das bainhas de mielina na velhice poderia determinar se este é o caso.
Os estudos de imagem ao vivo aqui discutidos avaliaram a dinâmica do comprimento da bainha de mielina, mas não a espessura da bainha de mielina. A espessura da bainha pode ser regulada de forma dinâmica? Estimular a sinalização PI3K/AKT/mTOR em oligodendrócitos de ratos adultos desencadeia o enrolamento adicional de mielina para aumentar a espessura da bainha (Snaidero et al., 2014). Isto pode ser modulado pela atividade do circuito, já que a estimulação neuronal leva ao aumento da espessura da bainha tanto em ratos jovens quanto adultos (Gibson et al., 2014; Mitew et al., 2018). Isto realça a necessidade de imaginar todos os parâmetros da bainha longitudinalmente para compreender completamente a dinâmica da remodelação da bainha. Há uma necessidade de modalidades de imagens vivas para medir com precisão a espessura da bainha ao longo dos axônios, já que atualmente isso requer uma medição transversal por microscopia eletrônica, o que limita a análise a um único ponto de tempo. Algumas técnicas de imagem sem rótulo, como a microscopia de terceira geração harmônica e a reflectometria espectral, mostram promessa para a realização dessas medições (Lim et al., 2014; Kwon et al., 2017). Acoplando estas técnicas com estudos longitudinais do córtex roedor poderia determinar se as bainhas de mielina estabelecidas podem ajustar sua espessura, ou se a atividade neuronal simplesmente empurra de nova mielinização para produzir bainhas mais espessas.
Parece portanto que, embora as bainhas de mielina sejam capazes de remodelar quando a mielina é rompida, a maioria das bainhas são geralmente estáveis em comprimento. Esta estabilidade é potencialmente devida à manutenção de padrões de mielinização estabelecidos precocemente otimizados para a função do circuito.
O Futuro
Estudos de imagem de mamíferos recentes têm focado a mielinização de novo e a remodelação da bainha em matéria cinzenta cortical. Circuitos corticais recebem e enviam informações através de muitas regiões, como a medula espinhal e o corpus calosum, e assim, alterações na mielina em várias áreas diferentes do SNC poderiam alterar a sinalização em um único circuito. O SNC é tradicionalmente descrito pela aparência após a fixação do formaldeído, onde “matéria branca” descreve as vias axonais fortemente mielinizadas, enquanto “matéria cinzenta” descreve regiões densamente recheadas de corpos celulares neuronais, dendritos e sinapses. Entretanto, essa classificação é excessivamente simplista; os OPCs produzem oligodendrócitos mielinizantes tanto na matéria cinza quanto na branca (Dawson et al., 2003) e, de fato, há evidências emergentes de diversidade na linhagem oligodendrógica e nos padrões de mielinização tanto na matéria cinza quanto na branca (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Tal diversidade pode refletir os requisitos únicos da mielina em áreas distintas, e potencialmente em circuitos distintos, do SNC. Outros estudos de imagem longitudinais são necessários para entender melhor a dinâmica da mielinização de novo e remodelação da bainha em áreas do SNC além do córtex.
Embora a transparência óptica do zebrafish larvar se preste a imagens vivas não invasivas, realizar tais experimentos no SNC de mamíferos é mais invasivo e tecnicamente desafiador. Hill et al. (2018) e Hughes et al. (2018) utilizaram a microscopia de dois fotões com janelas de imagem craniana para imagearem profundidades de até 400 μm no córtex. Técnicas similares poderiam ser usadas para a imagem de trajetos mielinizados superficiais na medula espinhal ao longo do tempo (Locatelli et al., 2018), mas regiões mais profundas do SNC não podem ser penetradas apenas pela microscopia de dois fótons. Uma alternativa é utilizar a microendoscopia de dois fotões, onde uma sonda de microendoscópio com um índice de refracção gradiente (GRIN) é inserida no tecido para imaginar células mais profundas no cérebro. No entanto, a inserção do endoscópio pode levar a respostas inflamatórias que podem impactar a mielinização. Uma alternativa poderia ser a microscopia de três fótons usando o método de janela de imagem craniana, que também já foi usado anteriormente para a imagem do hipocampo (Horton et al., 2013; Ouzounov et al., 2017). A microscopia de três fotões dá uma relação sinal/fundo significativamente maior do que a microscopia de dois fotões e pode, portanto, ser usada para a imagem de estruturas teciduais mais profundas.
É particularmente importante considerar não apenas diferentes regiões do SNC, mas diferentes neurônios dentro destas regiões. Pesquisas anteriores sugerem que existem diferenças mecanicistas em como subtipos distintos de neurônios regulam sua mielinização (Koudelka et al., 2016). Além disso, pode haver diversidade na regulação local da mielina. É essencial lembrar que diferentes partes do SNC não são entidades separadas, mas estão interligadas. Integrar a mesoscala conectiva, que se concentra na compreensão das conexões de diferentes subtipos de neurônios em diferentes regiões (Zeng, 2018), será crucial para nossa compreensão de como a dinâmica da mielinização ao longo da vida varia entre diferentes circuitos.
Qual é a conseqüência funcional da regulação da mielina ao longo de circuitos distintos? Até agora, as implicações funcionais só podem ser inferidas por correlações com o comportamento. Em última análise, há uma necessidade de acoplar a medição da dinâmica da mielina com a avaliação direta da atividade do circuito. Isso exigirá o registro da atividade neuronal durante estudos longitudinais de mielinização, a fim de conectar diretamente a mielinização de novo ou a remodelação da bainha observada às mudanças na função do circuito com o tempo. Será importante medir a dinâmica da mielina e a atividade eletrofisiológica de neurônios e axônios individuais para determinar como as mudanças nos vários parâmetros da bainha da mielina realmente afetam as propriedades de condução em nível de célula única, assim como avaliar a atividade em nível populacional. Ferramentas como Ca2+ codificados geneticamente ou indicadores de tensão permitem o registro relativamente não invasivo da atividade do circuito, e podem até mesmo ser usados para avaliar a atividade do circuito de todo o cérebro (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Conclusão
A mielinização dos axônios representa um poderoso mecanismo potencial para regular a função do circuito ao longo da vida. Pesquisas demonstraram que a mielinização de novo no córtex (através da produção de novos oligodendrócitos) ocorre mesmo na idade adulta, e que isto pode ser melhorado através da estimulação da atividade do circuito. Uma vez formada, a mielina é estável, com pouca rotação de oligodendrócitos e remodelação limitada do comprimento das bainhas de mielina existentes. No entanto, estas estruturas estáveis podem manter a capacidade de remodelação se a mielina for perturbada. Isto tem implicações interessantes em relação à plasticidade da mielina na manutenção da função do circuito durante a lesão, doença e velhice. Precisamente como as mudanças na mielina afetam a função do circuito subjacente ainda está por ser visto. Por fim, uma abordagem em nível de circuito, integrando análise da dinâmica da mielina com medição direta da função do circuito, é necessária para apreciar plenamente como a mielinização dinâmica influencia a função geral do sistema nervoso ao longo da vida.
Contribuições dos autores
Todos os autores listados fizeram uma contribuição substancial, direta e intelectual ao trabalho, e aprovaram para publicação.
Funding
DAL é apoiado por uma Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW é apoiado por um Ph.D. University of Edinburgh Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) e pelo Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z).
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Dinâmica neuronal cerebral durante a adaptação motora em zebrafish. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., e Lyons, D. A. (2017). Sobre a plasticidade do axônio mielinizado e formação e função do circuito neuronal. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., e Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Evidências para remodelação da bainha de mielina no SNC reveladas por imagens in vivo. Moeda. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Morte celular e controle da sobrevivência celular na linhagem oligodendrócita. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., e Ffrench-Constant, C. (2015). O comprimento da bainha de mielina do SNC é uma propriedade intrínseca dos oligodendrócitos. Moeda. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., e Trapp, B. D. (2000). NG2-positivo oligodendrócito progenitor de células progenitoras em cérebro humano adulto e lesões de esclerose múltipla. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Envelhecimento e estrutura da matéria branca cerebral em 3.513 participantes do Biobank do Reino Unido. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Os oligodendrócitos individuais têm apenas algumas horas para gerar novas bainhas de mielina in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., e Reynolds, R. (2003). NG2 – Expressão das células progenitoras glial: uma população abundante e disseminada de células cíclicas no SNC do rato adulto. Mol. Célula. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). A expressão BCAS1 define uma população de oligodendrócitos mielinizantes precoces em lesões de esclerose múltipla. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Um novo mecanismo de plasticidade do sistema nervoso: mielinização dependente de atividade. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Afinação das propriedades do nó Ranvier e dos internódios nos axônios mielinizados para ajustar o tempo potencial de ação. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). A atividade neuronal promove oligodendrogenese e mielinização adaptativa no cérebro dos mamíferos. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., e Grutzendler, J. (2018). Plasticidade cortical da mielina ao longo da vida e degeneração relacionada com a idade no cérebro de mamíferos vivos. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., e Nishiyama, A. (2014). Modulação da geração de oligodendrócitos durante uma janela temporal crítica após a divisão celular NG2. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). Microscopia in vivo de três fótons de estruturas subcorticais dentro de um cérebro de rato intacto. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). A caça mutante baixa a mielina regula a expressão do gene da mielina mediada pelo fator regulador e afeta os oligodendrócitos maduros. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., and Bergles, D. E. (2013). Os progenitores oligodendrócitos equilibram o crescimento com a auto-repulsão para alcançar a homeostase no cérebro adulto. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., e Bergles, D. E. (2018). Myelin remodeleling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). Imagem in vivo do cérebro de mamíferos usando microendoscopia de fluorescência de um e dois fótons. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneração e regeneração deficiente dos oligodendrócitos de matéria cinzenta na esclerose lateral amiotrófica. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Os subtipos neuronais individuais exibem diversidade na mielinização do SNC mediada pela liberação da vesícula sináptica. Moeda. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). A sinalização através de receptores AMPA em precursores de oligodendrócitos promove a mielinização ao melhorar a sobrevivência dos oligodrócitos. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Metrologia óptica em nanoescala livre de rótulos em axônios mielinizados in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., e Webb, W. W. (2004). Microscopia in vivo multi-fóton de tecido cerebral profundo. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., e Melendez-Vasquez, C. V. (2014). Imagens sem rótulo da mielinização das células de Schwann por microscopia de terceira geração harmônica. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Os fagócitos mononucleares especificam e adaptam localmente o seu fenótipo num modelo de esclerose múltipla. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Circuitos ancestrais para a modulação coordenada do estado cerebral. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., e Rockel, C. (2006). O crescimento da matéria branca como mecanismo de desenvolvimento cognitivo em crianças. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). A aprendizagem de habilidades motoras requer mielinização central ativa. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). A estimulação farmacogenética da actividade neuronal aumenta a mielinização de uma forma axónica específica. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Embrulhado para se adaptar: mielinização dependente da experiência. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). Imagens in vivo de três fótons de atividade de neurônios marcados com GCaMP6 no fundo do cérebro intacto do rato. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Mudanças acopladas na microestrutura da matéria branca do cérebro e na inteligência dos fluidos em vida posterior. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2 glia gera oligodendrócitos mielinizantes e neurônios piriformes de projeção em camundongos adultos. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). A aprendizagem de habilidades motoras induz mudanças na microestrutura da matéria branca e mielinização. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Relações entre o amadurecimento da matéria branca e o tempo de reação na infância. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., e Grutzendler, J. (2014). Imagem in vivo sem rótulo de axônios mielinizados em saúde e doença com microscopia de reflectância confocal espectral. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., e Johansen-berg, H. (2009). O treinamento induz mudanças na arquitetura de matéria-branca. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Envolvimento da membrana de mielina dos axônios do SNC por PI(3,4,5)Crescimento polarizado dependente de P3 na língua interna. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., e Buxbaum, J. D. (2011). Ligando oligodendrócito e disfunção de mielina a anormalidades do neurocircuito na esquizofrenia. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Perfis distintos da distribuição da mielina ao longo de eixos únicos de neurônios piramidais no neocórtex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). Notável estabilidade de oligodendrócitos mielinizantes em ratos. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., e Dimou, L. (2013). O transplante revela diferenças regionais na diferenciação dos oligodendrócitos no cérebro adulto. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., e Barres, B. A. (2008). Estágios distintos de mielinização regulados por gama-secretase e astrocitos em um sistema de cocultura de mielinização rápida do SNC. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinantes da velocidade de condução em fibras nervosas mielinizadas. Nervo Muscular 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). A produção rápida de novos oligodendrócitos é necessária nas primeiras etapas da aprendizagem das habilidades motoras. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dinâmica da geração de oligodendrócitos e mielinização no cérebro humano. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoscale connectomics. Moeda. Opinião. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar