Aspartato Aminotransferase por Luke Spooner
Conteúdo
- 1 Função
- 2 Estrutura
- 3 Função
- 4 Aplicações clínicas
- 5 Estruturas 3D de aspartato aminotransferase
Função
Aminotransferase de aspartato (AAT), também conhecida como transaminase glutâmica aspártica, transaminase glutâmica oxaloacética, aminotransferase pré-fenada e transaminase A é uma enzima que faz parte da família da aminotransferase dependente do fosfato piramidoxal. É codificada pelo gene GOT1. É um homodímero que tem 413 aminoácidos de comprimento e desempenha um papel crítico no metabolismo de aminoácidos e carboidratos, ureogênese e transferência de equivalentes redutores para as mitocôndrias e cloroplastos. Dentro das células procariotas encontra-se exclusivamente no citosol, mas nas células eucarióticas existem citosol, mitocôndrias e isozimas cloroplásticas. A aminotransferase bifuncional de aspartato (BAAT) é necessária para a transaminação do prefanato em arogenado.
No corpo humano é produzida no cérebro, músculos esqueléticos, fígado, pâncreas, glóbulos vermelhos, e rins. A grande variedade de tecidos em que é feito, separa-o da enzima similar transaminase alanina (ALT) que é encontrada principalmente no fígado. O nível de AAT no corpo pode ser usado como um marcador para doenças ou danos nos tecidos. Também, os níveis de AAT e ALT podem ser comparados para determinar se os danos dos tecidos são encontrados principalmente no fígado.
Estrutura
que contém (Hélices Alfa, Cordões Beta , Laços , Voltas). Unidade assimétrica de Aspartato aminotransferase, com domínio pequeno e grande destacado e cofactor de PLP (1b4x). Cada subunidade contém um local ativo equivalente. As subunidades se conectam em dois locais: entre seus grandes domínios e entre os resíduos terminais N e o grande domínio na outra subunidade. Esta estrutura de AST varia minuciosamente entre organismos que vão desde E. coli a humanos. Além disso, a estrutura do sítio ativo é altamente conservada com uma homologia de seqüência de 25%.
Cada subunidade do homodímero é ainda dividida em um domínio pequeno e grande. A subunidade é composta pelos aminoácidos do resíduo N-terminus a Pro 48 e do Met 326 a C-terminus. Os restantes aminoácidos compõem o , e os estão conectados por uma longa α-helix consistindo de 32 aminoácidos.
O grande domínio é onde o site ativo da AAT é encontrado e para acomodar isso, o núcleo contém muitas estruturas supersecundárias α/β. Isto é contrastado com o núcleo da pequena subunidade que é formada a partir de duas estruturas α-helices e duas estruturas β. Em organismos multicelulares há uma dobra no 325º resíduo que atua como uma dobradiça para o pequeno domínio, o que permite as mudanças conformacionais resultantes que ocorrem com a ligação dos inibidores à enzima.
Como foi dito acima, o local ativo do AST está situado no domínio grande da subunidade. Dentro do local ativo está o amino resíduo Lys 258, também conhecido como aldimina interna, que se liga com o cofator Pyridoxal 5′-fosfato () formando o que é chamado de uma base Schiff. Com a adição de um substrato de aminoácido, forma-se uma nova base de Schiiff entre a PLP e o aminoácido.
Função
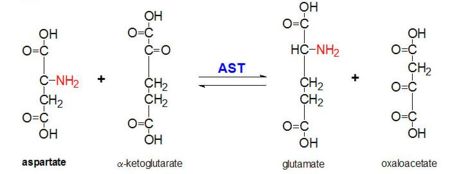
Figure 2: Reacção de transaminação de L-aspartato e α-ketoglutarato catalisado por aspartato aminotransferase
AAT catalisa a transaminação reversível do grupo α-amino de L-aspartato para α-ketoglutarato formando oxaloacetato e glutamato. Esta reatividade é menor em E.coli do que em eucariotas mais altas, e tem uma especificidade de substrato mais ampla. No entanto, a reacção ocorre da mesma forma. Após a introdução de um substrato de aminoácidos, uma nova base de Schiff formará entre ele e o cofactor de PLP. Isto faz com que o aminoácido perca um hidrogênio e forme um quinoide intermediário, e a reprotanação ocorre resultando em uma cetimina. Em seguida, a estrutura é hidrolisada formando um ácido α-keto e fosfato de piridoxamina. O aspartato de 2-metil age como inibidor da AAT quando forma uma base de Schiif com o cofactor PLP, em vez de aspartato. Isto resulta na paragem do processo no passo anterior à eliminação da proteína alfa.
Esta reacção é essencial para manter a homeostase nos organismos. As quatro moléculas diferentes que podem formar como resultado desta transanimação (oxaloacetato, α-ketoglutarato, aspartato, L-glutamato) são nossas críticas para uma série de processos metabólicos. O oxaloacetato e o α-ketoglutarato desempenham um papel crítico no ciclo de Krebs, formas variadas de aspartato são moléculas importantes no ciclo da uréia e participam da gluconeogênese, e o glutamato é uma molécula importante nas vias metabólicas associadas à memória.
Aplicações clínicas
Os níveis de AAT no organismo são indicativos de danos e doenças dos tecidos. Normalmente o AAT é encontrado em quantidades mínimas no sangue, no entanto, quando os órgãos acima mencionados são danificados, o AAT é liberado no sangue. A quantidade liberada é proporcional ao nível de dano sofrido. Os níveis de AAT aumentaram substancialmente dentro de 6 horas após a degradação inicial do tecido e podem permanecer elevados por até 4 dias. Os níveis de AAT quando comparados com os níveis de outras enzimas podem ser usados pelos médicos para determinar em que parte do corpo ocorreram os danos. As comparações com ALT revelaram-se particularmente úteis na identificação de danos hepáticos, como cirrose e hepatite. Em condições normais, os níveis de AAT dentro dos homens são de 6-34 UI/L e para as mulheres é de 8-40 UI/L.
Estruturas 3D de aspartato aminotransferase
Estruturas 3D de aspartato aminotransferase