Dependência nas reações químicas
Neste capítulo, aprenderemos sobre algumas reações nas quais os passos-chave envolvem o movimento de elétrons únicos. Você pode se lembrar de muito atrás na seção 6.1A que o movimento de elétrons simples é representado por uma seta de “gancho de peixe” de uma barra (ao contrário das setas familiares de barra dupla que temos usado ao longo do livro para mostrar o movimento de dois elétrons).

Mecanismos de elétron único envolvem a formação e posterior reação de espécies de radicais livres, intermediários altamente instáveis que contêm um elétron não emparelhado. Vamos aprender neste capítulo como os radicais livres são frequentemente formados a partir da clivagem homolítica, um evento em que os dois elétrons de uma ligação covalente quebrada se movem em direções opostas.

(Em contraste, essencialmente todas as reações que estudamos até agora envolvem eventos de quebra de ligação em que ambos os elétrons se movem na mesma direção: isto é chamado clivagem heterolítica).
Também vamos aprender que muitos mecanismos de um único elétron tomam a forma de uma reação em cadeia radical, na qual um radical causa a formação de um segundo radical, que por sua vez causa a formação de um terceiro radical, e assim por diante.
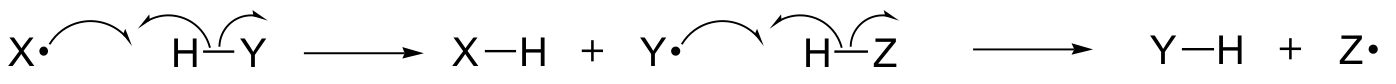
A alta reatividade das espécies de radicais livres e sua capacidade de iniciar reações em cadeia é muitas vezes benéfica – vamos aprender neste capítulo sobre reações de polimerização radical que formam materiais úteis como o plexiglass e o tecido de polipropileno. Também aprenderemos sobre reações radicais que são prejudiciais, tais como a degradação do ozônio atmosférico pelo freon, e os danos oxidativos feitos aos lipídios e DNA em nossos corpos pelas espécies de radicais livres. Finalmente, veremos como algumas enzimas usam metais ligados para catalisar e
A geometria e estabilidade relativa dos radicais de carbono
Como químicos orgânicos, estamos particularmente interessados em intermediários radicais nos quais o elétron não emparelhado reside em um átomo de carbono. Evidências experimentais indicam que as três ligações em um radical de carbono têm geometria trigonal plana, e portanto o carbono é considerado como sp2-hibridizado com o elétron não-parado ocupando o 2pzorbital perpendicular, não-hibridizado. Contraste este quadro com a carbocalização e os intermediários do carbônio, que também são ambos planares trigonais, mas cujos orbitais 2pz contêm zero ou dois elétrons, respectivamente.

A tendência na estabilidade dos radicais de carbono é paralela à das carbocações (seção 8.4B): os radicais terciários, por exemplo, são mais estáveis que os secundários, seguidos pelos radicais primário e metilo. Isto deve fazer sentido intuitivo, porque os radicais, tal como as carbonações, podem ser considerados deficientes em electrões e, portanto, são estabilizados pelos efeitos dadores de electrões dos grupos alquilo próximos. Os radicais benzílicos e alélicos são mais estáveis que os radicais alquílicos devido aos efeitos de ressonância – um electrão não emparelhado pode ser deslocalizado sobre um sistema de ligações pi conjugadas. Um radical alélico, por exemplo, pode ser retratado como um sistema de três orbitais paralelos de 2pz compartilhando três elétrons.
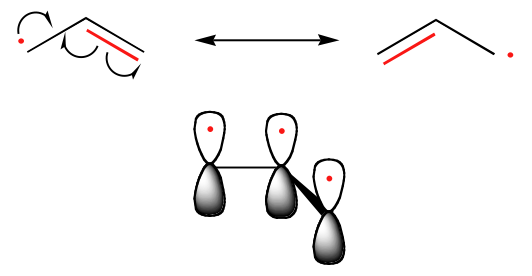
Tendências em estabilidade radical
Alélico & Benzílico > 3o > 2o > 1o > Metilo

Nesta molécula, a já extensa estabilização de ressonância é ainda mais reforçada pela capacidade dos átomos de cloro de proteger o centro do radical de reagentes externos. O radical está, em certo sentido, dentro de uma ‘gaiola’ protectora.
Química Orgânica com Ênfase Biológica por Tim Soderberg (Universidade de Minnesota, Morris)
-
Prof. Steven Farmer (Universidade Estadual de Sonoma)
- Layne A. Morsch (Universidade de Illinois Springfield)