A secção anterior mostra como diferentes elementos podem existir por si só ou combinar-se com outros elementos para fazer compostos. Esta seção se baseia nestas idéias, analisando as reações químicas com mais detalhes. Também mostra como a estenografia química pode ser estendida para descrever reações químicas.
Primeiro, considere algumas das moléculas descritas anteriormente: água, metano, dióxido de carbono e amônia.
Pergunta 26
Quais são as fórmulas para cada uma destas quatro moléculas?
Resposta
As fórmulas são H2O, CH4, CO2 e NH3, respectivamente.
Embora não seja necessário recordar as fórmulas químicas dos compostos introduzidos neste curso, provavelmente será útil memorizar algumas como as das quatro moléculas acima, mais as de hidrogénio (H2), nitrogénio (N2) e oxigénio (O2) moléculas. Isto irá ajudá-lo a ler e escrever estas fórmulas químicas sem se referir continuamente às secções anteriores.
Agora irá olhar para as reacções envolvendo os elementos hidrogénio, carbono e oxigénio e os compostos metano, água e dióxido de carbono.
Hidrogénio irá reagir com o oxigénio quando este for inflamado (é bastante explosivo) para formar água. Para escrever tal reação em termos de uma equação química, as substâncias que sofrem a reação são colocadas à esquerda e as substâncias que são produzidas na reação são colocadas à direita. Os reagentes à esquerda estão ligados aos produtos à direita por uma seta.
A equação pode ser escrita como uma palavra equação ‘hidrogénio e oxigénio fazem água’ ou, usando um pequeno estenógrafo químico, pode ser escrito como:

onde a seta significa ‘vai para’.
Agora, tente usar o estenógrafo químico para escrever a equação. Substituindo símbolos na palavra equação dá:

A equação mostra os reagentes à esquerda da seta sendo convertida para o produto à direita. No entanto, há algo de errado com esta equação. Você pode ver o que está errado olhando a Figura 21 onde os reagentes e produtos são mostrados como um diagrama.
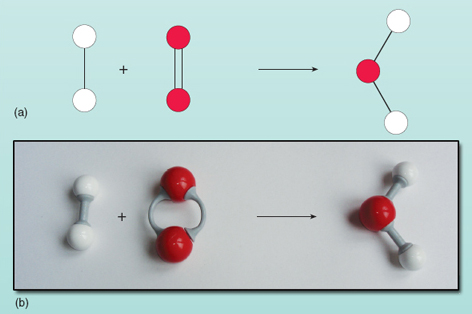
Contando os números de átomos em cada lado da equação mostra que existem dois átomos de oxigénio à esquerda em comparação com um à direita. O número de átomos de oxigênio em ambos os lados da equação deve ser igual – eles não podem aparecer e desaparecer magicamente durante uma reação. Não é possível alterar a composição da molécula da água à direita da equação, pois a molécula da água existe como um grupo de dois átomos de hidrogénio e um átomo de oxigénio todos ligados entre si. Cada molécula de oxigénio fornece dois átomos de oxigénio, pelo que formará sempre duas moléculas de água, desde que existam duas moléculas de hidrogénio (cada uma sendo uma unidade de dois átomos) para reagir com ela. Assim, duas moléculas de hidrogénio e uma molécula de oxigénio são necessárias para formar duas moléculas de água. A reação é exatamente expressa por:

Existem agora os mesmos números de cada tipo de átomo em ambos os lados da equação: a equação química é equilibrada, então podemos agora substituir a seta por um sinal de igual.
Uma arrumação final – para evitar a repetição das moléculas de hidrogênio à esquerda da equação e as moléculas de água à direita é para representá-las por 2H2 em vez de H2 + H2. Assim a equação química balanceada torna-se:

Isto é mostrado esquematicamente na Figura 22.

Equações químicas mostram de forma muito concisa não só quais átomos e moléculas reagem juntos para formar os produtos, mas também quantos de cada tipo de átomo e molécula estão envolvidos. É importante lembrar que o número antes de uma molécula significa o número dessa molécula em particular. Por exemplo 3H2O significa três moléculas de água, dando um total de seis átomos de hidrogênio e três átomos de oxigênio.
Equações químicas devem equilibrar-se; o número de átomos de cada tipo de elemento em ambos os lados da equação deve ser igual.
Você agora sabe como ‘ler’ ou interpretar uma equação química – e como ela representa um processo químico. No entanto, os químicos também são muito hábeis em escrever equações químicas como uma forma de abreviação para descrever vários processos químicos ou reacções. Escrever equações químicas é como escrever em qualquer língua estrangeira – requer prática para se tornar fluente. No entanto, todos os cientistas em início de carreira têm que começar em algum lugar e a seção abaixo mostra como fazer isso usando uma reação química muito familiar. Se você deseja verificar se precisa estudar esta seção, tente a Pergunta 20 primeiro.